Vie Aeree in Riparazione: Il Segreto è un Flusso Cellulare Guidato da Wnt
Ciao a tutti! Oggi voglio parlarvi di qualcosa di affascinante che succede dentro di noi, precisamente nelle nostre vie aeree, ogni volta che subiscono un danno. Avete mai pensato a come fanno i nostri polmoni e la nostra trachea a ripararsi dopo un’infezione, l’inalazione di sostanze irritanti o un qualsiasi altro insulto? È un processo incredibilmente complesso e orchestrato, e noi scienziati stiamo solo iniziando a svelarne i meccanismi più intimi.
Il rivestimento interno delle nostre vie aeree, l’epitelio, è la nostra prima linea di difesa, ma è anche delicato. Quando viene danneggiato, devono entrare in gioco delle cellule speciali, le cellule basali (BCs), che sono le vere e proprie cellule staminali di questo tessuto. Normalmente se ne stanno tranquille, ma quando serve si attivano, si moltiplicano e si differenziano per rimpiazzare le cellule perdute, come le cellule ciliate (quelle con le “ciglia” che spazzano via muco e detriti) e le cellule club (che producono secrezioni protettive).
Il Mistero della Migrazione Cellulare
Ma c’è un aspetto ancora più intrigante: per riparare efficacemente una lesione, queste cellule basali non basta che si dividano. Devono anche muoversi, migrare verso l’area danneggiata. Immaginate una sorta di “flusso” cellulare coordinato, un fenomeno che chiamiamo “fluidificazione epiteliale”. Questo movimento permette alle cellule di raggiungere rapidamente il punto dove c’è bisogno di ricostruire il tessuto. Ma come viene regolato questo spostamento? Quali segnali dicono alle cellule “Ehi, muovetevi tutte insieme verso di là!”? Fino a poco tempo fa, era un bel rompicapo.
La Scoperta: Entra in Scena Wnt Non-Canonico
Ed è qui che entra in gioco la nostra ricerca. Studiando modelli animali, in particolare la trachea di topo, abbiamo scoperto un protagonista chiave in questa storia: la via di segnalazione Wnt non-canonica. So che “Wnt” suona un po’ tecnico, ma pensatela come un sistema di comunicazione tra cellule, fondamentale per un sacco di processi biologici, dallo sviluppo embrionale alla rigenerazione dei tessuti.
Esistono due “versioni” principali di questa via: quella canonica (che coinvolge una proteina chiamata β-catenina) e quella non-canonica. Noi ci siamo concentrati su quest’ultima e abbiamo identificato alcuni attori molecolari cruciali:
- Una proteina recettore chiamata Ptk7
- Un altro recettore, Fzd7 (Frizzled7)
- Una molecola segnale chiamata Wnt5a
- Un attivatore a valle chiamato YAP
Sembra che questo quartetto lavori in concerto per dare il via e dirigere la migrazione delle cellule basali dopo un danno.
Vedere per Credere: L’Imaging dal Vivo
Come abbiamo fatto a capirlo? Abbiamo usato tecniche di imaging dal vivo su sezioni di trachea di topo mantenute in vita *ex vivo*. In pratica, abbiamo potuto “spiare” le cellule basali (marcate con una proteina fluorescente rossa, tdTomato) mentre si muovevano in tempo reale. Abbiamo indotto un danno in due modi: usando una sostanza chimica chiamata polidocanol, che danneggia le cellule differenziate in modo diffuso, oppure usando un laser ad alta potenza per creare una micro-ferita molto localizzata.
I risultati sono stati spettacolari! Nelle trachee non danneggiate, le cellule basali erano praticamente immobili. Ma un giorno dopo il danno da polidocanol, iniziava una vera e propria “danza” coordinata: le cellule si muovevano, cambiando forma, e l’area totale occupata dalle cellule aumentava, segno della “fluidificazione”. Dopo l’ablazione laser, vedevamo le cellule basali estendere delle specie di “braccia” (protrusioni) e muoversi attivamente verso il centro della ferita, chiudendola gradualmente. Questo movimento, abbiamo confermato, dipende dall’attività del citoscheletro di actina, perché bloccandolo con una sostanza chiamata Citocalasina B, le cellule smettevano di muoversi.

Identificare i Registi Molecolari
A questo punto, volevamo la prova definitiva che fosse proprio la via Wnt non-canonica a dirigere il traffico. Abbiamo usato topi geneticamente modificati in cui potevamo “spegnere” il gene Ptk7 specificamente nelle cellule basali. Ebbene, senza Ptk7, la migrazione cellulare era fortemente compromessa, sia dopo il danno da polidocanol sia dopo l’ablazione laser. Le cellule si muovevano molto meno e la ferita si chiudeva molto più lentamente.
Abbiamo ottenuto risultati simili usando un peptide inibitore che blocca specificamente Fzd7. Inoltre, abbiamo osservato che dopo il danno, proteine chiave della via non-canonica come Fzd7 e Dvl1 si localizzavano sulla membrana cellulare (la “corteccia” della cellula), un segno tipico dell’attivazione di questa via. Questa localizzazione corticale spariva se Ptk7 era assente.
Da Dove Arriva il Segnale Wnt5a?
Ok, Ptk7 e Fzd7 sono i recettori, ma chi manda il segnale? Abbiamo testato diverse molecole Wnt. Inibendo la secrezione di tutte le Wnt con un farmaco (LGK974), la migrazione si bloccava. Ma se bloccavamo solo la via canonica (inibendo la β-catenina con iCRT14) o aggiungevamo Wnt3a (tipica della via canonica), la migrazione non cambiava molto. Invece, aggiungendo Wnt5a (tipica della via non-canonica), la chiusura della ferita accelerava!
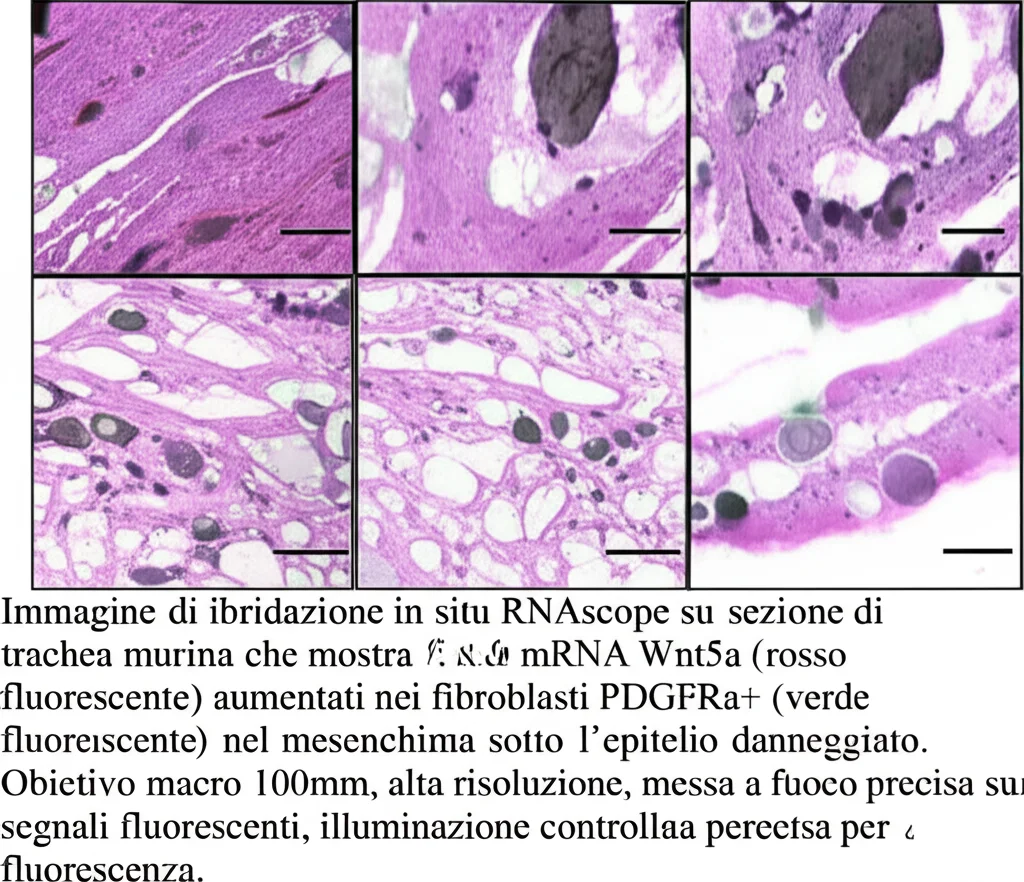
Questo ci ha convinto che Wnt5a fosse il segnale chiave. Ma chi lo produce? Abbiamo visto che Wnt5a si localizzava sulla corteccia delle cellule basali poco dopo il danno (e questa localizzazione dipendeva da Ptk7, confermando che Ptk7 agisce da co-recettore). Poi, usando una tecnica chiamata RNAscope per visualizzare l’mRNA (le “istruzioni” per produrre una proteina), abbiamo scoperto che i livelli di mRNA di Wnt5a aumentavano significativamente non tanto nelle cellule epiteliali, quanto nei fibroblasti presenti nel tessuto connettivo (mesenchima) sotto l’epitelio, subito dopo il danno. Sembra quindi che siano queste cellule di supporto a inviare il segnale Wnt5a alle cellule basali per farle muovere.
L’Attivatore Finale: YAP
La catena di comando non finisce qui. Studi precedenti avevano collegato la via Wnt non-canonica a un’altra proteina importante per la regolazione del citoscheletro e della crescita cellulare: YAP. E, guarda caso, YAP era già stato implicato nella migrazione delle cellule basali in altri contesti di danno polmonare. Abbiamo controllato: nelle cellule basali non danneggiate, YAP era diffusa nel citoplasma. Ma dopo il danno, YAP si spostava nel nucleo, segno della sua attivazione. E, cosa fondamentale, questa attivazione nucleare dipendeva da Ptk7! Se Ptk7 era assente, YAP restava fuori dal nucleo anche dopo il danno.
Infine, usando un inibitore di YAP (Verteporfina), abbiamo visto che la chiusura della ferita dopo ablazione laser veniva drasticamente rallentata. Questo chiude il cerchio: la via Wnt non-canonica (Wnt5a -> Fzd7/Ptk7 -> Dvl) attiva YAP, e YAP è necessario per la migrazione delle cellule basali.
Perché la Migrazione è Così Importante?
Potreste chiedervi: ma è davvero così fondamentale che queste cellule si muovano? Non basterebbe che si dividessero sul posto? La risposta è no. Abbiamo visto che quando impedivamo la migrazione bloccando Ptk7, l’intero processo di riparazione ne risentiva:
- Meno proliferazione: Le cellule basali si dividevano molto meno (misurato contando le cellule in mitosi con un marcatore specifico, PH3).
- Meno cellule differenziate: Dopo 5 giorni dal danno, c’erano molte meno cellule ciliate (Foxj1+) e cellule club (CC10+) rispetto ai controlli.
- Epitelio più sottile: Lo spessore complessivo dell’epitelio riparato era significativamente ridotto.
Quindi, la migrazione non è solo un dettaglio, ma è intimamente legata alla capacità delle cellule basali di proliferare e rigenerare un epitelio funzionale. Sembra che raggiungere il posto giusto sia fondamentale per poter poi fare il proprio lavoro di ricostruzione.

Un Modello Emerge
Mettendo insieme tutti i pezzi, emerge un modello affascinante (vedi schema sotto): un danno all’epitelio tracheale stimola i fibroblasti sottostanti a rilasciare Wnt5a. Questo segnale attiva i recettori Fzd7 e Ptk7 sulle cellule basali, innescando la via Wnt non-canonica attraverso Dvl. Questo, a sua volta, porta all’attivazione di YAP, che promuove la migrazione concertata delle cellule basali verso il sito della lesione e ne stimola anche la proliferazione. Questo processo coordinato è essenziale per una riparazione efficace e il ripristino della normale struttura e funzione delle vie aeree.
[Schema ideale: Fibroblasto rilascia Wnt5a -> Wnt5a lega Fzd7/Ptk7 su Cellula Basale -> Attivazione Dvl -> Attivazione YAP (nel nucleo) -> Migrazione + Proliferazione Cellula Basale -> Riparazione Epiteliale]
Implicazioni e Prospettive Future
Capire questi meccanismi non è solo una curiosità scientifica. Vie di segnalazione come Wnt e YAP sono spesso deregolate in malattie polmonari croniche come la fibrosi polmonare idiopatica (IPF) e la broncopneumopatia cronica ostruttiva (BPCO), dove i processi di riparazione sembrano “impazzire”. Una migrazione eccessiva o disfunzionale delle cellule basali potrebbe contribuire a queste patologie. I nostri risultati aprono la strada a future ricerche per capire se modulare questa via Wnt non-canonica possa rappresentare una strategia terapeutica per migliorare la riparazione delle vie aeree o correggere processi rigenerativi aberranti.
C’è ancora molto da scoprire, ad esempio come questa via interagisce con altri segnali (come l’interleuchina-6, anch’essa implicata nella migrazione) e come viene finemente regolata nel tempo e nello spazio durante le diverse fasi della riparazione. Ma ogni passo avanti nella comprensione di questi processi dinamici ci avvicina a poter un giorno intervenire in modo più mirato quando la rigenerazione naturale non funziona come dovrebbe.
Spero che questo viaggio nel mondo microscopico della riparazione delle vie aeree vi abbia affascinato quanto affascina me!
Fonte: Springer