Osso Nuovo di Zecca? La Scommessa Vinta con Staminali Dentali, un Gene Speciale e Stampa 3D!
Ciao a tutti! Oggi voglio parlarvi di qualcosa che mi appassiona da morire: come possiamo aiutare il nostro corpo a ripararsi, in particolare quando si tratta di ossa mancanti in punti delicati come la bocca. Immaginate un bambino che nasce con una schisi del palato e dell’alveolo (la parte ossea che tiene i denti). È una sfida enorme, non solo estetica ma anche funzionale.
La Sfida della Ricostruzione Ossea
Fino ad oggi, la soluzione più comune è prelevare un pezzetto d’osso da un’altra parte del corpo del paziente (spesso dall’anca) e trapiantarlo lì dove serve. Questa tecnica, chiamata innesto osseo autologo, funziona, non c’è dubbio, ma diciamocelo: non è una passeggiata. È un intervento invasivo, può lasciare dolore persistente, cicatrici, rischio di infezioni e a volte richiede pure altri interventi. Insomma, non proprio l’ideale, specialmente per pazienti giovani. Ecco perché noi ricercatori ci stiamo dando da fare per trovare alternative migliori, meno invasive e magari anche più efficaci. Ed è qui che entra in gioco l’ingegneria tissutale ossea.
L’Ingegneria Tissutale: Costruire Osso su Misura
L’idea di base dell’ingegneria tissutale è quasi fantascientifica: usare una combinazione di cellule speciali, segnali biologici e impalcature (scaffold) per “convincere” il corpo a rigenerare il tessuto mancante. Nel nostro caso, l’osso alveolare. Sembra promettente, vero? Lo è, ma siamo ancora agli inizi. Ci sono stati studi interessanti, ma manca ancora un consenso su quali siano le cellule migliori, i segnali più efficaci e gli scaffold ideali per questo specifico problema. C’è bisogno di più ricerca per ottimizzare la ricetta!
Le Nostre Protagoniste: Le Cellule Staminali Dentali
Per la nostra ricetta, abbiamo puntato su un tipo particolare di cellule staminali: quelle che si trovano nei denti! In particolare, abbiamo usato le cellule staminali del follicolo dentale (DFSC) e le cellule staminali della polpa dentale (DPSC). Perché proprio loro? Beh, sono relativamente facili da ottenere (ad esempio da denti estratti per motivi ortodontici, che altrimenti verrebbero buttati via), si moltiplicano bene in laboratorio, hanno una fantastica capacità di trasformarsi in vari tipi di cellule, incluse quelle ossee (osteoblasti), e sollevano meno questioni etiche rispetto ad altre fonti di staminali. Le DFSC, in particolare, sono le progenitrici naturali delle cellule dell’osso alveolare, quindi sembravano la scelta perfetta!
Ma non ci siamo fermati qui. Abbiamo pensato: cosa succederebbe se mettessimo queste due popolazioni di cellule a “lavorare insieme”? Studi precedenti suggerivano che la co-coltura (cioè farle crescere vicine, anche se non a diretto contatto) potesse migliorare le loro performance. Durante lo sviluppo dei denti, DFSC e DPSC interagiscono. Abbiamo quindi provato a coltivarle insieme in laboratorio, usando un sistema chiamato Transwell che le tiene separate da una membrana porosa ma permette loro di scambiarsi segnali. E indovinate un po’? Abbiamo visto che le DFSC in co-coltura con le DPSC si moltiplicavano di più! Un primo indizio che eravamo sulla strada giusta.

Il Fattore X: Il Gene CA1
Ok, abbiamo le cellule giuste e un modo per renderle più attive. Ma per costruire osso serve anche uno stimolo forte, un segnale che dica alle cellule: “Ehi, è ora di mettersi al lavoro e produrre matrice ossea!”. I fattori di crescita tradizionali usati in ingegneria tissutale (come le BMP) funzionano, ma hanno dei limiti: spesso ne servono grandi quantità perché vengono diluiti e degradati rapidamente nel corpo, e questo alza i costi e può avere effetti collaterali.
Qui entra in gioco la nostra scoperta più intrigante: un gene chiamato CA1 (Anidrasi Carbonica 1). Di solito, questo gene è noto per altre funzioni, ma i nostri studi preliminari ci avevano mostrato una cosa sorprendente: CA1 gioca un ruolo chiave nel processo di differenziazione osteogenica delle DFSC, cioè nella loro trasformazione in cellule ossee. Sembra agire “a monte” nella cascata di segnali che portano alla formazione dell’osso, influenzando anche le famose BMP. E la cosa bella è che, usando una tecnica con un lentivirus modificato (totalmente sicuro per questo tipo di esperimenti), siamo riusciti a far sì che le DFSC producessero molta più proteina CA1 in modo stabile e controllato. Poteva essere questo il nostro “fattore X”?
La Casa Perfetta: Lo Scaffold 3D
A questo punto avevamo le cellule potenziate (DFSC trattate con CA1 e co-coltivate con DPSC) e il segnale giusto. Mancava solo l’impalcatura, la “casa” dove queste cellule potessero attecchire, crescere e iniziare a costruire il nuovo osso. La scelta dello scaffold è cruciale: deve essere biocompatibile (non deve dare rigetto), biodegradabile (deve riassorbirsi man mano che si forma l’osso nuovo), poroso (per permettere alle cellule e ai vasi sanguigni di penetrarlo) e avere proprietà meccaniche adeguate.
Noi abbiamo optato per un materiale composito: PoliCaproLattone (PCL) e β-fosfato tricalcico (β-TCP). Il β-TCP è noto per le sue ottime capacità osteoconduttive (aiuta l’osso a crescere sulla sua superficie) e biocompatibilità. Il PCL è un polimero biodegradabile che dà struttura e lavorabilità. Combinandoli e usando la stampa 3D, abbiamo creato degli scaffold cubici (4x4x3 mm) con una struttura porosa controllata, perfetti per accogliere le nostre cellule. Abbiamo verificato in laboratorio che le cellule aderivano bene allo scaffold (circa l’80% di adesione!) e che lo scaffold non ne ostacolava la crescita. La casa era pronta!

La Prova del Nove: L’Esperimento In Vitro e In Vivo
Era il momento di mettere insieme tutti i pezzi. In laboratorio (in vitro), abbiamo confrontato tre gruppi di DFSC:
- Gruppo di controllo (cellule normali)
- Gruppo LV-CA1 (cellule con CA1 potenziato)
- Gruppo LV-CA1 + Co-coltura (cellule con CA1 potenziato e co-coltivate con DPSC)
Le abbiamo indotte a differenziarsi in cellule ossee per 21 giorni e abbiamo misurato l’espressione di geni chiave per la formazione dell’osso, come ALP, BMP2 e RUNX2. I risultati sono stati netti: il gruppo LV-CA1 + Co-coltura mostrava livelli significativamente più alti di tutti questi marcatori rispetto agli altri due gruppi, sia a livello di mRNA che di proteine. La combinazione CA1 + co-coltura era davvero potente!
Ma la vera prova è sempre quella in vivo, nel modello animale. Abbiamo creato chirurgicamente un difetto osseo simile alla schisi alveolare in ratti adulti. Poi abbiamo impiantato i nostri scaffold 3D caricati con le cellule dei tre gruppi (nel gruppo di controllo, il difetto è stato lasciato vuoto o riempito con scaffold senza cellule, a seconda del confronto specifico).
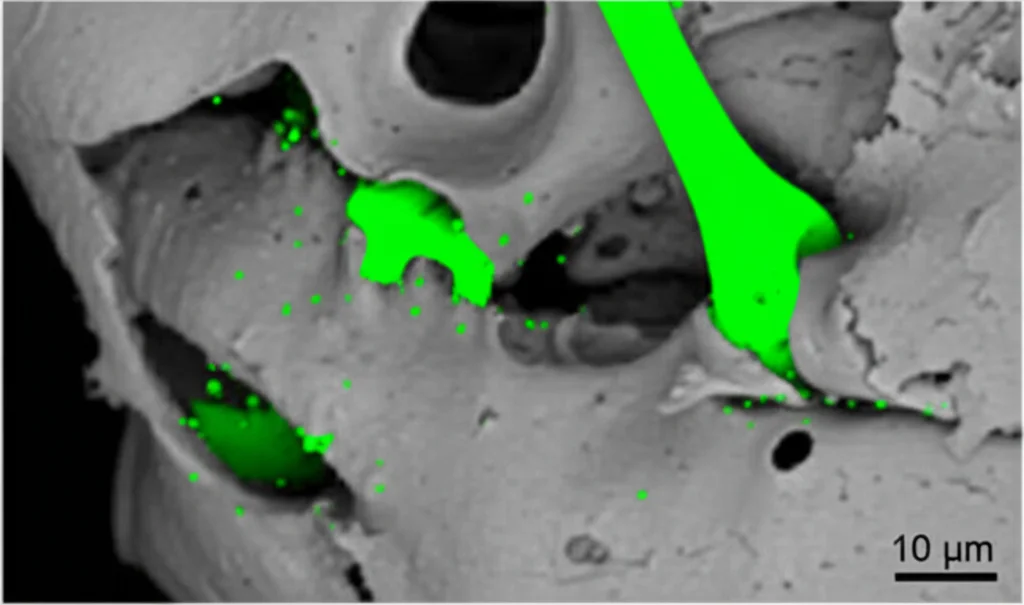
Dopo 4 e 8 settimane dall’intervento, abbiamo analizzato la quantità e la qualità del nuovo osso formato usando la micro-CT (una specie di TAC ad altissima risoluzione) e l’analisi istologica (osservando fettine sottilissime di tessuto al microscopio).
I risultati sono stati entusiasmanti! Già a 4 settimane, il gruppo LV-CA1 + Co-coltura aveva formato circa il 39.1% di osso nuovo nel difetto, contro il 23.4% del gruppo LV-CA1 e solo il 4.5% del controllo. A 8 settimane, la differenza era ancora più marcata: il gruppo LV-CA1 + Co-coltura aveva raggiunto un incredibile 56.9% di nuovo osso, rispetto al 38.5% del gruppo LV-CA1 e al 14% del controllo. Le differenze erano statisticamente significative.
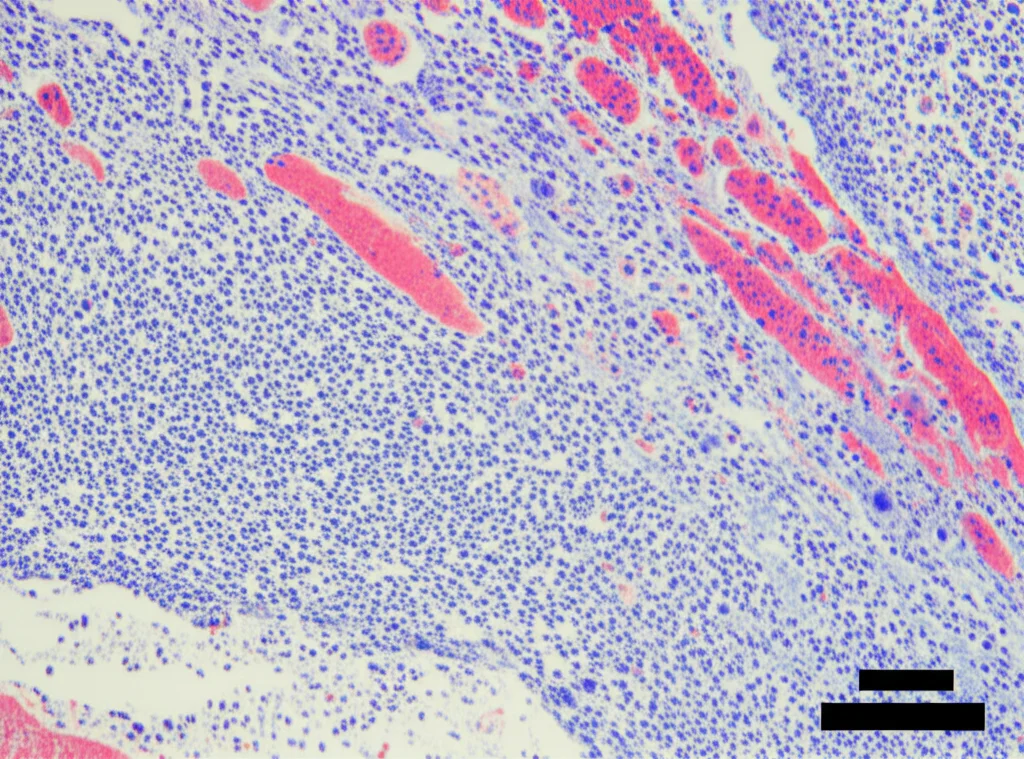
L’analisi istologica ha confermato questi dati: nel gruppo LV-CA1 + Co-coltura abbiamo osservato molto più osso neoformato, con trabecole ossee (le “impalcature” interne dell’osso) più dense e interconnesse e più collagene immaturo (segno di attiva deposizione di matrice ossea), rispetto agli altri gruppi.
Un Futuro Promettente per la Rigenerazione Ossea
Cosa significa tutto questo? Che la nostra strategia combinata – usare le DFSC, potenziarle con il gene CA1, farle collaborare con le DPSC tramite co-coltura e fornire loro una casa ideale con lo scaffold 3D PCL/β-TCP – funziona davvero! E funziona significativamente meglio rispetto all’uso delle sole cellule potenziate con CA1 o delle cellule non trattate.
Siamo convinti che questo approccio rappresenti una nuova strada promettente per la rigenerazione ossea nelle schisi alveolari. Certo, siamo ancora a livello preclinico (sui ratti), e serviranno ulteriori studi per ottimizzare il tutto e passare, si spera, alla sperimentazione clinica sull’uomo. Ma i risultati sono davvero incoraggianti.
L’idea di poter un giorno offrire ai pazienti con schisi alveolare una soluzione rigenerativa efficace, meno invasiva e basata sulle loro stesse cellule dentali (o cellule dentali da donatore conservate), è ciò che ci spinge ad andare avanti in questa ricerca affascinante. Stiamo letteralmente imparando a “convincere” il corpo a ricostruire ciò che manca, usando gli strumenti più avanzati della biologia e della tecnologia. Non è incredibile?
Fonte: Springer