Un Ingresso Segreto nel Cervello: Svelato un Sito Nascosto nel Trasportatore della Dopamina
Ciao a tutti! Oggi voglio portarvi con me in un viaggio affascinante nel microscopico mondo del nostro cervello, per parlarvi di una proteina che è una vera e propria superstar quando si tratta di regolare il nostro umore, la motivazione e persino i nostri movimenti: il trasportatore della dopamina, o più amichevolmente, DAT.
Questa proteina ha un compito cruciale: dopo che la dopamina – il famoso neurotrasmettitore del piacere e della ricompensa – ha fatto il suo lavoro comunicando tra i neuroni, il DAT la ricattura, riportandola nel neurone presinaptico. È un po’ come un efficientissimo servizio di pulizia che riordina lo spazio sinaptico. Non sorprende, quindi, che il DAT sia implicato in disturbi come l’ADHD, il morbo di Parkinson e le dipendenze da sostanze. Proprio per questo, è anche il bersaglio di molti farmaci, sia leciti che illeciti.
Ora, la domanda che ci siamo posti, e che ha tenuto banco per un bel po’ nel mondo scientifico, è: quanti “punti di attracco” o siti di legame ha davvero questa proteina per le varie molecole? E come funzionano esattamente? Le strutture cristallografiche e quelle ottenute con la crio-microscopia elettronica (crio-EM) ci mostravano chiaramente un sito di legame centrale, chiamato S1, dove si legano sia i substrati (come la dopamina stessa) sia gli inibitori. Però, simulazioni al computer ed esperimenti biochimici suggerivano l’esistenza di un secondo sito, chiamato S2, localizzato nel vestibolo extracellulare. Un bel rompicapo, no?
La Sfida: Perché Alcuni Siti Sono “Invisibili”?
Vi siete mai chiesti perché a volte le tecniche più avanzate sembrano “mancare” qualcosa? Noi abbiamo ipotizzato che la capacità di identificare un sito di legame con tecniche come la cristallografia a raggi X o la crio-EM potesse dipendere dalla forza del legame tra la molecola (il ligando) e la proteina. In pratica, se un legame è troppo debole, potrebbe sfuggire a queste analisi, che mediano su un gran numero di molecole. È un po’ come cercare di fotografare una farfalla che si posa per un istante brevissimo su un fiore: serve la tecnica giusta e molta sensibilità.
Il Nostro Approccio: La Spettroscopia di Forza a Singola Molecola
Per mettere alla prova questa idea, abbiamo deciso di usare un approccio davvero innovativo: la spettroscopia di forza a singola molecola, basata sulla microscopia a forza atomica (AFM). Immaginate di avere una “canna da pesca” incredibilmente piccola e sensibile. All’estremità dell’amo (la punta dell’AFM), abbiamo attaccato diverse molecole che interagiscono con il DAT, come un analogo della cocaina ad alta affinità (MFZ2-12) o la dopamina stessa. Poi, abbiamo “pescato” queste interazioni direttamente su cellule vive che esprimevano il DAT.
Misurando la forza necessaria per “staccare” il ligando dal DAT, potevamo ottenere informazioni preziose sulla forza e sulla cinetica di questi legami. È un po’ come misurare quanto forte bisogna tirare per separare due calamite.
Prime Indizi: Due “Strattoni” Distinti
E qui è arrivata la prima, grande sorpresa! Quando abbiamo analizzato le forze di distacco, abbiamo osservato non una, ma due popolazioni distinte di forze. Una più forte e una più debole. Questo ci ha subito fatto pensare: e se questi due “strattoni” corrispondessero ai due famosi siti di legame, S1 e S2? Era come se la nostra “esca” potesse attaccarsi in due posti diversi sul DAT, con “appiccicosità” differenti.
Abbiamo notato che la presenza di ioni zinco (Zn2+) influenzava queste interazioni. Lo zinco, legandosi a un sito specifico sul DAT, sembra stabilizzare la proteina in una conformazione “aperta verso l’esterno”, facilitando il legame dei ligandi. Curiosamente, l’assenza di zinco rendeva il legame al sito più forte (quello che poi identificheremo come S1) ancora più robusto, anche se meno probabile. Forse perché, senza zinco, il trasportatore può “chiudersi” meglio attorno al ligando, stringendolo più forte.

Identificare il Sito S1: Il “Cuore” del Trasportatore
Per capire quale popolazione di forze corrispondesse al sito S1, quello centrale e ben noto, abbiamo fatto un po’ i “chirurghi molecolari”. Abbiamo introdotto delle mutazioni specifiche in residui aminoacidici che sapevamo essere cruciali per il sito S1, come S422A e V152I. E voilà! In queste versioni mutate del DAT, la popolazione di forze di distacco più forti diminuiva drasticamente, mentre quella delle forze più deboli rimaneva pressoché invariata. Questo era un chiaro segnale: gli eventi di distacco più forti provenivano dal sito S1.
Un’altra conferma è arrivata sostituendo gli ioni sodio (Na+) nel mezzo extracellulare con ioni potassio (K+) o NMDG+. Il legame al sito S1 è noto per essere dipendente dal sodio. E infatti, senza sodio, gli “strattoni” forti diminuivano, mentre quelli deboli, provenienti dal presunto sito S2, non ne risentivano. Bingo!
Svelare il Sito S2: L’Ingresso Nascosto
A questo punto, eravamo piuttosto convinti che gli eventi di legame più deboli appartenessero a un secondo sito, il nostro S2 “nascosto”, localizzato nel vestibolo extracellulare. Per confermarlo, abbiamo preso di mira altri residui aminoacidici, questa volta situati proprio in quella regione: K92, K384, G386 e H477.
La mutazione G386H, per esempio, ha indebolito ulteriormente il legame al sito S2, come se avessimo messo un piccolo ostacolo all’ingresso. Poi, abbiamo usato un trucco chimico: abbiamo trattato le cellule con una sostanza (sulfo-NHS-acetato) che acetila specificamente le lisine accessibili dall’esterno, come K92 e K384. Dopo questo trattamento, la popolazione di legami deboli si è ridotta, indicando che almeno una di queste lisine era coinvolta nel sito S2. Successive mutazioni singole (K92A e K384A) hanno confermato che entrambe le lisine K92 e K384 partecipano al sito S2.
E l’istidina H477? Questo residuo è interessante perché il suo equivalente nel trasportatore della serotonina (SERT) è coinvolto nel legame al sito S2 per alcuni antidepressivi. Non potendo mutare H477 nel DAT senza compromettere il suo arrivo sulla membrana cellulare, abbiamo cambiato il pH della soluzione esterna da 7.4 a 5.5. L’istidina è l’unico aminoacido con un pKa in questo range, quindi a pH 5.5 si protona. E cosa abbiamo osservato? Il picco delle forze deboli (S2) è quasi scomparso, mentre quello delle forze forti (S1) è rimasto. Questo ci ha detto che anche H477 è un giocatore chiave nel sito S2.
È affascinante notare come questo sito S2 che abbiamo “scovato” condivida una porzione significativa con un sito modulatorio allosterico recentemente descritto in una struttura crio-EM del DAT. Le cose si fanno sempre più interessanti!
Cinetica del Legame: Non Solo Forza, Ma Anche Velocità
Grazie alla nostra tecnica, non ci siamo limitati a misurare la forza, ma abbiamo anche potuto calcolare le costanti cinetiche di associazione (kon) e dissociazione (koff) per entrambi i siti. In pratica, quanto velocemente un ligando si lega e quanto velocemente si stacca. Questi dati sono fondamentali perché l’affinità di un farmaco non dipende solo da quanto “forte” si lega, ma anche da questo equilibrio dinamico.
Abbiamo scoperto, ad esempio, che in assenza di zinco, il legame al sito S1 era più lento ad instaurarsi (kon più basso) ma, una volta formato, era molto più stabile (koff più basso). Lo zinco, invece, accelerava l’associazione a S1, ma rendeva il complesso un po’ meno stabile. Per il sito S2, il legame era generalmente più rapido a dissociarsi rispetto a S1, confermando la sua natura più “transitoria” o debole.

A Cosa Serve il Sito S2? Un “Aiutante” per l’Ingresso?
Una delle domande più intriganti è: qual è la funzione di questo sito S2? I nostri dati suggeriscono qualcosa di molto interessante. Quando abbiamo modificato il sito S2 (tramite mutazioni o trattamenti chimici), abbiamo osservato una significativa riduzione della velocità con cui la dopamina si legava al sito S1 (kon di S1 diminuito). Questo ci porta a pensare che il sito S2 possa agire come una sorta di “sito di reclutamento” o “filtro di selettività”, aiutando la dopamina (e forse altri ligandi) a trovare la strada verso il sito di legame principale S1, più profondo. Un po’ come un imbuto che facilita l’ingresso.
Questo potrebbe essere cruciale per la selettività dei farmaci. Alcuni studi precedenti avevano già suggerito che la differenza di affinità di certi composti tra DAT e SERT dipendesse più dalle velocità di associazione che da quelle di dissociazione. Il nostro sito S2 potrebbe essere proprio il meccanismo alla base di questa selettività.
Nessun Effetto Allosterico Positivo da S1 a S2 nel DAT
Nel trasportatore della serotonina (SERT), si era visto che il legame di un antidepressivo al sito S1 potenziava il legame di un’altra molecola di antidepressivo al sito S2 (un effetto allosterico positivo). Ci siamo chiesti se accadesse lo stesso nel DAT. Abbiamo quindi provato a “riempire” il sito S1 con dopamina o MFZ2-12 e poi a misurare il legame al sito S2. Sorprendentemente, non abbiamo osservato alcun aumento della forza di legame a S2. Questo indica una differenza funzionale importante tra DAT e SERT, probabilmente dovuta a come i cambiamenti conformazionali indotti dal legame in S1 si propagano (o non si propagano) al sito S2.
La “Soglia di Visibilità”: Perché l’AFM Vede Ciò Che Altri Non Vedono
Torniamo alla nostra ipotesi iniziale: perché il sito S2 del DAT è così elusivo nelle strutture cristallografiche o crio-EM? Confrontando i nostri dati di forza con quelli ottenuti per il SERT (dove entrambi i siti sono stati visualizzati strutturalmente in alcuni casi), abbiamo potuto stimare una sorta di “soglia di forza di legame”. Se un’interazione è al di sotto di questa soglia (stimata tra 10.1 e 13.4 pN a una certa velocità di caricamento della forza), potrebbe risultare “invisibile” alle tecniche strutturali tradizionali.
Questo perché queste tecniche mediano su un vasto numero di molecole e, anche se un sito debole fosse occupato al 100% in soluzione, a livello di singola molecola la sua bassa energia di legame potrebbe portare a una delocalizzazione o distacco durante i lunghi processi di preparazione del campione o di acquisizione dati, “scomparendo” nella media. L’AFM, invece, con la sua capacità di rilevare eventi di legame a singola molecola, ha una sensibilità molto più alta per questi siti a bassa affinità.
Implicazioni Future: Farmaci Più Intelligenti e Oltre
La scoperta e la caratterizzazione di questo sito S2 “nascosto” nel DAT apre scenari davvero eccitanti. Prima di tutto, per il drug design. Conoscere la posizione e le proprietà di siti di legame secondari e più deboli è di valore immediato per progettare molecole bitopiche o bivalenti. Si tratta di farmaci che possiedono due “teste” (farmacofori), una che si lega al sito primario (S1) e una al sito secondario (S2), connesse da un linker della giusta lunghezza e flessibilità. Questo approccio potrebbe portare a farmaci con maggiore affinità, migliore selettività tra i trasportatori (DAT, SERT, NET), minori effetti collaterali e un’efficacia ottimizzata.
Pensate, ad esempio, a farmaci per l’ADHD o la depressione che agiscano in modo più mirato e con un profilo di sicurezza superiore. La nostra capacità di “vedere” questi siti deboli potrebbe essere la chiave.
Inoltre, il principio che abbiamo dimostrato qui – cioè che l’AFM può svelare siti di legame a bassa affinità sfuggenti ad altre tecniche – è universale. Ci aspettiamo che questo approccio possa essere applicato ad altre proteine di membrana, come canali ionici, recettori e altri trasportatori, aprendo nuove frontiere nella comprensione della loro funzione e nella scoperta di nuovi farmaci.
In sintesi, il nostro lavoro fornisce la prova fisica dell’esistenza di un secondo sito di legame (S2) nel trasportatore della dopamina, accessibile in un contesto fisiologico. Abbiamo svelato la sua posizione, la sua dinamica e il suo possibile ruolo. Queste scoperte non solo ci aiutano a decifrare i meccanismi fondamentali della funzione del DAT in salute e malattia, ma offrono anche opportunità concrete per disegnare terapie migliori. È un piccolo passo per una proteina, ma un grande passo per la neurofarmacologia!
Fonte: Springer
]] Mantenere questo tag CDATA per la formattazione corretta del codice.
https://scienzachiara.it/wp-content/uploads/2025/05/195/031_visualizzazione-artistica-e-scientifica-del-trasportatore-della-dopamina-dat-con-un-sito-di-legame-nascosto-illuminato-suggerendo.webp
Visualizzazione artistica e scientifica del trasportatore della dopamina (DAT) con un sito di legame nascosto illuminato, suggerendo una nuova scoperta. Molecole di dopamina fluttuano nelle vicinanze. Dettaglio elevato, illuminazione drammatica per enfatizzare la scoperta, obiettivo macro 70mm, profondità di campo.
Neuroscienze
Scoperta di un sito di legame nascosto nel trasportatore della dopamina (DAT) tramite spettroscopia di forza. Implicazioni per farmaci e disturbi neurologici.
trasportatore della dopamina, DAT, sito di legame, S1, S2, AFM, spettroscopia di forza, neurotrasmissione, farmaci, dopamina
sito-nascosto-trasportatore-dopamina-cervello
Sito Nascosto DAT: Rivoluzione Farmaci Dopamina?
DAT
<
Mettiamoci alla Prova: L’Analisi agli Elementi Finiti in 3D
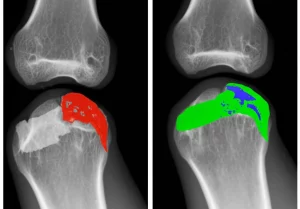
Ed eccoci al cuore del nostro studio! Abbiamo preso un volontario maschio di 30 anni, sano come un pesce (o quasi, almeno per quanto riguarda il ginocchio sinistro!), e abbiamo scannerizzato il suo ginocchio con TAC e Risonanza Magnetica. Con questi dati, abbiamo creato un modello 3D super dettagliato del suo ginocchio: ossa, cartilagini, menischi, legamenti… tutto!
Su questo modello, abbiamo simulato tre diverse tecniche di ricostruzione del LCP, ognuna con un diverso posizionamento del tunnel tibiale:
- Modello 1: Posizionamento al centro della regione anatomica dell’LCP (il metodo classico).
- Modello 2: Posizionamento nel punto di Fanelli (10 mm sotto e 5 mm laterale al punto anatomico).
- Modello 3: Il nostro nuovo metodo, con riferimento ai tessuti molli (5 mm sopra la plica capsulare distale e 5 mm mediale al setto posteriore).
Per tutti e tre i modelli, l’innesto aveva un diametro di 7 mm. Poi, abbiamo simulato il classico test del “cassetto posteriore”: ginocchio flesso a 90 gradi e una spinta all’indietro sulla tibia di 5 mm, misurando tutte le forze e gli stress in gioco. Un vero e proprio stress test virtuale!
I Risultati Parlano Chiaro (o Quasi!)
Ebbene, i risultati sono stati davvero interessanti. Partiamo dallo stress da contatto (Cpress) tra l’innesto e il tunnel tibiale, che è un buon indicatore dell’attrito. Il nostro Modello 3 ha mostrato uno stress da contatto significativamente più basso (22.57 MPa) rispetto al Modello 1 (32.93 MPa) e al Modello 2 (29.86 MPa). Bingo! Meno attrito, proprio come speravamo.
Anche il rapporto tra la forza di contatto e l’area di contatto effettiva (in pratica, la pressione specifica sull’innesto) è risultato il più basso nel Modello 3. Questo suggerisce che il nostro metodo distribuisce meglio le forze, riducendo le aree di carico elevato.
E lo stress sul piatto tibiale? Ancora una volta, il Modello 3 ha registrato il valore più basso (48.80 MPa). Questo è importante perché indica che l’interazione tra l’innesto e la tibia, ovvero l’attrito, è minima con la nostra tecnica.
C’è un “ma”, o meglio, un dato da interpretare con attenzione. Lo stress tensile sull’innesto (PCL Mises stress), cioè la forza che “tira” il legamento, è risultato più alto nel Modello 3 (69.71 MPa) rispetto agli altri due (circa 41 MPa). Questo significa che, nel nostro Modello 3, l’innesto lavora di più in tensione e meno per attrito. È un problema? Non necessariamente.

Tiriamo le Somme: Meno Attrito, Più Tensione. È un Buon Compromesso?
Quindi, cosa ci dicono questi numeri? Che il nostro metodo con riferimento ai tessuti molli (Modello 3) sembra ottimizzare il contatto tra l’innesto e la tibia, riducendo drasticamente l’attrito e minimizzando l’effetto “killer turn”. Questo è un enorme passo avanti per ridurre il rischio di usura dell’innesto.
Certo, l’innesto subisce una tensione maggiore. Ma dobbiamo considerare che gli innesti moderni, come quelli da tendini semitendinoso e gracile, sono molto resistenti alla trazione (si parla di una resistenza fino a 4000 N, contro i 1800 N dell’LCP nativo!). Quindi, è probabile che possano sopportare questo aumento di tensione, specialmente se il vantaggio è una drastica riduzione dell’attrito, che è uno dei principali nemici della longevità dell’innesto. E poi, volendo, si potrebbe sempre pensare di usare innesti di diametro leggermente maggiore per gestire carichi tensionali più alti, visto che in clinica si usano diametri tra 8 e 12 mm.
Un altro aspetto positivo del nostro approccio è che il punto di uscita del tunnel tibiale rimane all’interno della regione anatomica, il che è fisiologicamente più corretto rispetto al punto di Fanelli. Inoltre, la tecnica chirurgica che abbiamo sviluppato per questo posizionamento, utilizzando un approccio postero-mediale doppio, offre un campo visivo chiaro e riduce i rischi di danneggiare nervi o vasi sanguigni.
Occhio alle Limitazioni e Sguardo al Futuro
Come ogni studio, anche il nostro ha delle limitazioni. Abbiamo usato il modello di un singolo volontario, quindi i dati andranno confermati su campioni più ampi e variegati. Abbiamo simulato un test statico, mentre il ginocchio si muove in modi molto più complessi nella vita reale. E, naturalmente, una simulazione al computer, per quanto sofisticata, non replica al 100% la realtà biologica.
Tuttavia, i risultati sono incoraggianti e si aggiungono alle prove positive che già avevamo da studi anatomici e clinici. Credo davvero che questo approccio possa offrire una nuova, valida opzione per la ricostruzione del LCP, migliorando potenzialmente i risultati a lungo termine per i pazienti.
In conclusione, la nostra analisi agli elementi finiti suggerisce che il posizionamento del tunnel tibiale con riferimento ai tessuti molli, pur sottoponendo l’innesto a una maggiore forza tensile, riduce in modo significativo l’attrito con la tibia. Questo potrebbe tradursi in una minore usura dell’innesto e, quindi, in una maggiore stabilità biomeccanica nel tempo. La strada è ancora lunga e servono studi clinici a lungo termine per confermare queste scoperte, ma siamo decisamente sulla buona… traccia!

Fonte: Springer