Retinopatia Diabetica: Le Micro-Vescicole MSC e il miR-125a-5p Accendono una Nuova Speranza!
Ciao a tutti, appassionati di scienza e curiosi! Oggi voglio parlarvi di una scoperta che mi ha davvero entusiasmato e che potrebbe cambiare le carte in tavola per chi combatte contro la retinopatia diabetica, una delle principali cause di cecità negli adulti a livello globale. Immaginate delle minuscole “navicelle” biologiche, chiamate vescicole extracellulari piccole (sEV), derivate da cellule staminali mesenchimali (MSC), che trasportano un carico prezioso per riparare i danni agli occhi. Sembra fantascienza, vero? Eppure, è proprio quello di cui stiamo per parlare!
Il Problema: Quando il Diabete Minaccia la Vista
Partiamo dalle basi. Il diabete, purtroppo, è una condizione sempre più diffusa: pensate che oggi colpisce circa 1 adulto su 10, e le stime dicono che questo numero salirà vertiginosamente nei prossimi anni. La retinopatia diabetica è la sua complicanza oculare più temuta. All’inizio può essere subdola, senza sintomi evidenti, ma se non trattata può progredire rapidamente, portando a una perdita permanente della vista. In pratica, i vasi sanguigni e i neuroni della retina si deteriorano gradualmente, causando disfunzioni, rottura della barriera emato-retinica (BRB) e la formazione di nuovi vasi anomali.
Un ruolo cruciale in questo scenario è giocato dalle cellule di Müller. Queste cellule sono fondamentali per mantenere l’integrità della BRB e supportare i neuroni retinici. Quando le cellule di Müller vanno in tilt, si possono verificare edemi e neurodegenerazione, spesso prima ancora che i problemi ai vasi sanguigni diventino evidenti. L’aumento dei livelli di glucosio, tipico del diabete, scatena stress ossidativo e un’attivazione anomala di queste cellule.
Lo stress ossidativo è un vero e proprio cattivo in questa storia. L’eccessiva produzione di specie reattive dell’ossigeno (ROS) danneggia i tessuti intorno ai capillari retinici, contribuendo alla progressione della retinopatia. E c’è di più: alterazioni epigenetiche possono far persistere questo stress ossidativo anche quando i livelli di glucosio nel sangue tornano normali, un fenomeno chiamato “memoria metabolica”. L’esposizione prolungata a livelli elevati di glucosio danneggia i mitocondri, le centrali energetiche delle nostre cellule, portando a una maggiore produzione di radicali liberi e a gravi anomalie metaboliche. La disfunzione mitocondriale si manifesta con ridotta sintesi di ATP (la nostra “benzina” cellulare), alterato potenziale di membrana mitocondriale, sovrapproduzione di ROS e problemi con la mitofagia – un processo vitale che elimina i mitocondri danneggiati.
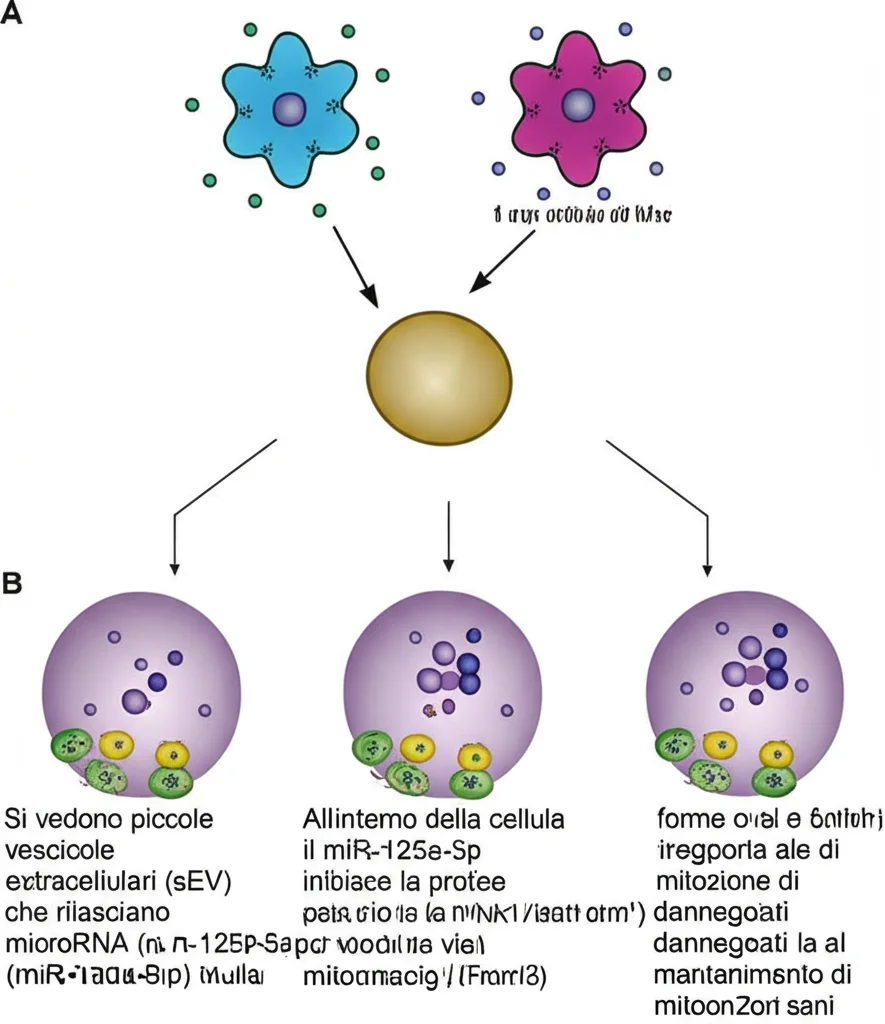
Una Nuova Strategia: Le Vescicole Extracellulari Piccole (sEV) delle Cellule Staminali Mesenchimali (MSC)
Negli ultimi anni, c’è stato un crescente interesse per le cellule staminali mesenchimali (MSC) come approccio terapeutico per varie malattie oculari. Queste cellule sembrano migliorare l’angiogenesi, ridurre il danno da stress ossidativo e accelerare la riparazione dei tessuti. Ma la cosa affascinante è che molti degli effetti benefici delle MSC non sono dovuti alle cellule stesse, ma a ciò che rilasciano: le vescicole extracellulari piccole (sEV). Queste sEV sono come dei postini microscopici che trasportano sostanze bioattive alle cellule bersaglio, modificandone il comportamento. È stato dimostrato che le sEV derivate da MSC hanno un potenziale significativo nel migliorare la funzione mitocondriale.
Tuttavia, fino a poco tempo fa, non era chiaro come queste sEV potessero regolare lo stress ossidativo e la funzione mitocondriale, in particolare la mitofagia, nella retinopatia diabetica. Ed è qui che entra in gioco lo studio di cui vi parlo oggi!
I ricercatori hanno voluto esplorare gli effetti terapeutici e i meccanismi d’azione delle sEV rilasciate dalle MSC sia su un modello di ratto diabetico (indotto da streptozotocina, STZ) sia su cellule di Müller “stressate” in laboratorio con prodotti di glicazione avanzata (AGEs), che simulano l’ambiente diabetico. Le sEV sono state ottenute dal terreno di coltura di MSC umane del cordone ombelicale (hUC-MSC) con una tecnica di ultracentrifugazione. Analisi al microscopio elettronico a trasmissione (TEM), analisi del tracciamento nanoparticellare (NTA) e test western blot hanno confermato le loro caratteristiche: particelle sferiche, con una doppia membrana, di dimensioni tra 100 e 200 nm, e positive per marcatori specifici come CD81 e TSG101.

Cosa Hanno Scoperto i Ricercatori? Risultati Promettenti!
Nei ratti diabetici, l’iniezione intravitreale di MSC-sEV ha portato a notevoli miglioramenti:
- Miglioramento della morfologia istologica della retina.
- Miglioramento della funzione della barriera emato-retinica, con riduzione della perdita vascolare (misurata con il colorante Blu di Evans).
- Riduzione della gliosi delle cellule di Müller (un segno di attivazione e stress cellulare, evidenziato dalla ridotta espressione della proteina GFAP).
- Diminuzione dell’espressione della proteina PTP1B (Protein Tyrosine Phosphatase 1B), un enzima implicato in diverse complicazioni diabetiche.
- Riduzione dello stress ossidativo (minore produzione di ROS, misurata con il colorante DHE).
- Diminuzione dell’apoptosi (morte cellulare programmata), con un aumento della proteina anti-apoptotica BCL-2 e una diminuzione di quella pro-apoptotica BAX.
È stato anche confermato che le MSC-sEV, marcate con un colorante fluorescente rosso (DiD), venivano effettivamente internalizzate dalle cellule di Müller nella retina dei ratti. Questo è un passaggio chiave, perché dimostra che il “carico” arriva a destinazione!
Il Meccanismo d’Azione: miR-125a-5p e la Via di PTP1B
Ma come fanno queste sEV a fare tutto questo? I ricercatori hanno scavato più a fondo. Hanno scoperto che le MSC-sEV sono ricche di microRNA (miRNA), piccole molecole di RNA non codificante che possono regolare l’espressione genica. Attraverso analisi di sequenziamento e bioinformatica, hanno identificato un miRNA specifico, il miR-125a-5p, come potenziale attore chiave. Questo miR-125a-5p sembrava essere in grado di “spegnere” il gene PTP1B.
Esperimenti in vitro su cellule di Müller esposte ad AGEs hanno confermato il ruolo cruciale di questo meccanismo:
- Le MSC-sEV riducevano l’accumulo di ROS e miglioravano la struttura e la funzione dei mitocondri.
- Le MSC-sEV attivavano la mitofagia nelle cellule di Müller trattate con AGEs. Questo è stato evidenziato da un aumento del rapporto LC3II/LC3I, di TOM20, PINK1 e Parkin (proteine chiave della mitofagia) e una diminuzione di P62 (una proteina che si accumula quando la mitofagia è bloccata).
- Fondamentalmente, se si inibiva il miR-125a-5p nelle sEV, i loro effetti protettivi venivano annullati.
- Allo stesso modo, se si induceva una sovraespressione di PTP1B nelle cellule di Müller, gli effetti benefici delle sEV venivano ridotti.
Quindi, il quadro che emerge è questo: le MSC-sEV trasportano il miR-125a-5p alle cellule di Müller. Qui, il miR-125a-5p sopprime l’espressione di PTP1B. La riduzione di PTP1B, a sua volta, sembra favorire la mitofagia mediata da PINK1/Parkin, aiutando le cellule a eliminare i mitocondri danneggiati, riducendo così lo stress ossidativo e l’apoptosi.
Le immagini al microscopio elettronico a trasmissione delle cellule di Müller hanno mostrato chiaramente i difetti mitocondriali indotti dagli AGEs (frammentazione, gonfiore, perdita delle creste mitocondriali) e come la terapia con sEV proteggesse i mitocondri. Anche il potenziale di membrana mitocondriale (MMP), un indicatore della salute mitocondriale, diminuiva con gli AGEs e veniva ripristinato dalle sEV. Questi effetti positivi venivano compromessi se si usavano sEV prive di miR-125a-5p o se PTP1B era sovraespresso.
Cosa Significa Tutto Questo per il Futuro?
Questi risultati sono davvero promettenti! Suggeriscono che il miR-125a-5p contenuto nelle sEV derivate da MSC può alleviare il danno alle cellule di Müller nella retinopatia diabetica modulando la mitofagia attraverso la via di PTP1B. In pratica, queste micro-vescicole potrebbero rappresentare un approccio terapeutico innovativo e mirato per trattare la retinopatia diabetica.
Certo, come in ogni ricerca, ci sono delle limitazioni. Ad esempio, nello studio è stata usata una singola dose di sEV, e ulteriori ricerche dovranno chiarire gli effetti di somministrazioni precoci o ripetute. Inoltre, il modello in vitro con AGEs, sebbene utile, non replica completamente la complessità dell’ambiente della retinopatia diabetica. Sarà anche necessario approfondire l’esatto meccanismo con cui PTP1B modula la via PINK1-Parkin per ostacolare la mitofagia.
Nonostante ciò, questo studio apre una nuova, entusiasmante prospettiva. L’idea di utilizzare “messaggeri” naturali come le sEV, carichi di molecole terapeutiche come il miR-125a-5p, per “riprogrammare” le cellule danneggiate e ripristinare la loro funzione è affascinante e potrebbe avere implicazioni che vanno ben oltre la retinopatia diabetica.
Io continuerò a seguire con grande interesse gli sviluppi in questo campo, sperando che queste scoperte possano tradursi presto in nuove terapie per i pazienti. E voi, cosa ne pensate? Non è incredibile il potenziale nascosto nel nostro stesso organismo?
Fonte: Springer







