Rame Potenziato: La Nuova Arma Segreta Contro il Killer dei Pesci d’Allevamento?
Ciao a tutti! Oggi voglio parlarvi di un problema serio che affligge il mondo dell’acquacoltura, un nemico subdolo che causa perdite economiche non indifferenti: la Saprolegnia parasitica. No, non è un mostro marino uscito da un film horror, ma un oomicete, una specie di muffa acquatica, che provoca una malattia chiamata saprolegniasi, particolarmente devastante per pesci come salmoni e pesci gatto. Immaginate delle crescite bianche, simili a cotone, che compaiono sui pesci, specialmente se feriti o sulle loro uova. Non è un bello spettacolo e, peggio ancora, è spesso letale.
Un Nemico Difficile da Sconfiggere
Combattere la saprolegniasi è una vera sfida. Per anni si sono usati diversi metodi, alcuni dei quali, come il verde malachite, si sono rivelati efficaci ma poi sono stati banditi per i loro effetti tossici e cancerogeni. Attualmente, le opzioni approvate dalla FDA americana sono pochissime. Recentemente, il solfato di rame è emerso come un’alternativa promettente ed economica. C’è un però: la sua efficacia può variare molto a seconda della qualità dell’acqua locale, in particolare della sua durezza. Se l’acqua non è “giusta”, il rame potrebbe non funzionare come dovrebbe, o peggio, accumularsi e diventare tossico per gli stessi pesci che dovrebbe proteggere. Un bel grattacapo, vero? Inoltre, anche l’acido peracetico, un’altra opzione esplorata, ha i suoi limiti, come la stabilità e l’acidificazione dell’acqua. Si sono testati anche estratti naturali da piante, ma spesso non si capisce bene quale sia il principio attivo e come funzioni esattamente.
L’Idea: Dare una Mano al Rame
Di fronte a queste difficoltà, ci siamo chiesti: e se potessimo rendere il rame più “cattivo” contro la *Saprolegnia*, ma in modo intelligente? Se potessimo aiutarlo a entrare nelle cellule del patogeno per massimizzare la sua tossicità, magari usando dosi più basse sia di rame che del nostro “aiutante”? Qui entrano in gioco delle piccole molecole chiamate ionofori. Pensate a loro come a delle minuscole “navette” specializzate nel trasportare ioni (come quelli di rame, Cu2+) attraverso le membrane cellulari. L’ipotesi era che, combinando il solfato di rame con piccole quantità di ionofori specifici, avremmo potuto superare i problemi legati alla solubilità del rame nell’acqua e aumentarne l’efficacia contro *S. parasitica*. Una strategia furba, no?
Alla Ricerca degli Alleati Perfetti
Per testare la nostra idea, abbiamo messo su un esperimento in laboratorio. Prima di tutto, abbiamo sviluppato un terreno di coltura “sintetico” e chimicamente definito (lo abbiamo chiamato 2222X) per far crescere la nostra *Saprolegnia parasitica* in condizioni controllate. Questo è importante perché ci permette di sapere esattamente cosa c’è nel “brodo di coltura”, specialmente per quanto riguarda i metalli, senza le variabili introdotte da componenti naturali come l’estratto di lievito. Abbiamo poi coltivato l’oomicete in questo terreno aggiungendo diverse concentrazioni di solfato di rame per vedere quale fosse la dose “letale”. Abbiamo scoperto che circa 100 µM (micromolari) di rame dimezzavano la crescita (questo valore si chiama IC50), mentre a 200 µM la crescita si bloccava del tutto. Questo dato era in linea con altri studi.
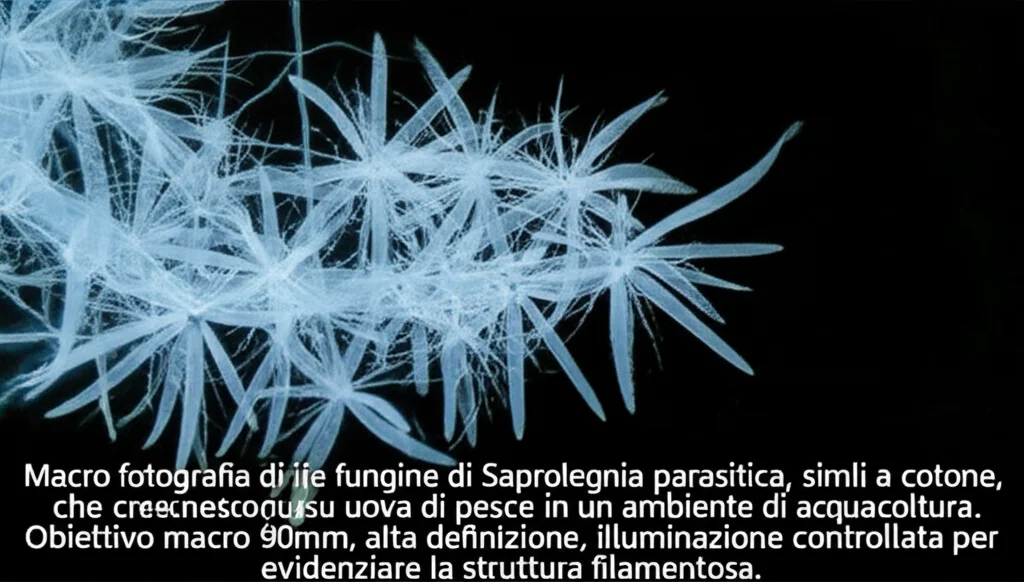
Poi è arrivato il momento clou: lo screening degli ionofori. Abbiamo preso una serie di piccole molecole candidate, note per legare o trasportare metalli, e le abbiamo testate a bassa concentrazione (10 µM) insieme a 100 µM di solfato di rame. E bingo! Abbiamo identificato un gruppo di composti che sembravano promettenti: tetraethylthiuram disulfide (TDD), ciclopirox olamine (CLP), 2-mercaptopyridine N-oxide (MPO), 5-chloro-8-hydroxy-7-iodoquinoline (CHI), 5,7-dichloro-8-hydroxyquinoline (DHQ) e 8-quinolinol (8QN). Questi composti, in combinazione con il rame, inibivano significativamente la crescita di *S. parasitica*. Alcuni di loro (MPOZ, un sale di zinco di MPO, e altri due) mostravano attività anche senza rame aggiunto, ma ci siamo concentrati su quelli che sembravano potenziare specificamente l’effetto del rame.
Capire Chi Fa Cosa (e Come)
Una volta identificati i candidati, volevamo capire meglio come funzionassero. Abbiamo misurato la loro tossicità “da soli” (senza rame aggiunto) e abbiamo visto che variava parecchio: alcuni erano abbastanza potenti già a concentrazioni inferiori a 2 µM (come CLP, MPO, DHQ, 8QN), mentre altri, come TDD, richiedevano dosi un po’ più alte. Poi abbiamo fatto l’esperimento cruciale: abbiamo tenuto fissa la concentrazione dell’ionoforo (vicino alla sua IC50) e abbiamo aggiunto quantità crescenti di rame. I risultati sono stati affascinanti! Per TDD, MPO e 8QN, bastavano poche “unità” di rame per ogni unità di ionoforo per ottenere la massima inibizione della crescita. Questo suggerisce che formano complessi con il rame molto efficientemente o lo trasportano dentro la cellula molto bene. Per CLP e DHQ, invece, serviva molto più rame, e non siamo nemmeno riusciti a bloccare completamente la crescita. CHI ha mostrato un comportamento ancora diverso, quasi “a gradini”. Questi risultati ci dicono che non tutti gli ionofori funzionano allo stesso modo con il rame.
Per essere sicuri che fosse proprio il rame a fare la differenza (e non solo l’ionoforo da solo), abbiamo usato un “trucco”: abbiamo aggiunto alla coltura una molecola chiamata BCS (bathocuproine sulfate). Il BCS è un chelante del rame, cioè lo “acchiappa” e lo tiene bloccato fuori dalla cellula, impedendogli di entrare. Ebbene, per TDD, CLP, MPO e 8QN, aggiungere BCS annullava l’effetto tossico della combinazione rame-ionoforo: *S. parasitica* tornava a crescere! Questo è stato la prova del nove: questi composti agiscono proprio aiutando il rame a entrare e a fare danni all’interno della cellula. Sorprendentemente, per CHI e DHQ, il BCS non solo non annullava l’effetto, ma a volte lo peggiorava! Questo suggerisce che CHI e DHQ potrebbero essere tossici per *S. parasitica* anche per conto loro, indipendentemente dal rame, o che il meccanismo sia più complesso.

Non Solo in Provetta: La Prova sul “Campo” (Solido)
Poiché *Saprolegnia* cresce sia sulle uova che sui pesci adulti (superfici solide), abbiamo voluto vedere se la nostra strategia funzionasse anche su un terreno di coltura solido (con agar). Abbiamo ripetuto gli esperimenti su piastre Petri. I risultati hanno confermato quanto visto in liquido: la combinazione rame-ionoforo inibiva la crescita dell’oomicete anche su supporto solido. Certo, abbiamo notato che servivano concentrazioni un po’ più alte, probabilmente perché l’agar può “rallentare” la diffusione delle molecole, ma la tendenza era la stessa. Questo è incoraggiante, perché suggerisce che questa strategia potrebbe funzionare sia per trattare le uova che i pesci infetti.
Ma Qual è il Meccanismo d’Azione? Stress Ossidativo?
Una delle ipotesi su come il rame in eccesso uccida le cellule è che provochi stress ossidativo, danneggiando proteine e altre molecole vitali. Abbiamo voluto verificare se fosse questo il caso con il nostro trattamento rame-MPO (abbiamo scelto MPO perché era uno dei più efficaci). Abbiamo misurato i livelli di proteine ossidate nelle cellule di *S. parasitica* dopo un breve trattamento. Sorprendentemente, non abbiamo trovato un aumento significativo dell’ossidazione generale delle proteine rispetto ai controlli. Questo non significa che lo stress ossidativo non c’entri nulla, ma suggerisce che il meccanismo principale della tossicità rame-MPO potrebbe essere più specifico, magari colpendo particolari vie metaboliche o processi cellulari. Ricerche recenti parlano di un meccanismo chiamato “cuproptosi”, una forma di morte cellulare programmata indotta specificamente dall’eccesso di rame che colpisce enzimi mitocondriali. Potrebbe essere questa la strada da esplorare in futuro.
Conclusioni e Prospettive Future
Quindi, cosa abbiamo imparato? Abbiamo dimostrato che combinare basse dosi di solfato di rame con piccole quantità di specifici ionofori (in particolare MPO, 8QN, TDD e CLP) potenzia notevolmente la sua capacità di uccidere *Saprolegnia parasitica*, sia in coltura liquida che solida. Questa strategia potrebbe rappresentare un modo più efficiente ed efficace per combattere la saprolegniasi in acquacoltura, potenzialmente riducendo la quantità totale di rame necessaria (il che è un bene per l’ambiente e per i pesci) e superando i problemi legati alla qualità dell’acqua. Il fatto che il meccanismo non sembri legato a uno stress ossidativo generalizzato apre la porta a studi futuri per capire esattamente come questa combinazione letale agisca a livello molecolare. Il nostro prossimo passo? Stiamo già lavorando per testare l’efficacia di queste combinazioni rame-ionoforo direttamente sulle uova di pesce gatto in sviluppo. Speriamo che questa ricerca possa portare presto a nuove armi per difendere i nostri amici pinnuti da questo fastidioso patogeno!
Fonte: Springer