Radioterapia e Cancro del Colon-Retto: Il Colesterolo è il Traditore che Non Ti Aspetti?
Ciao a tutti! Oggi voglio parlarvi di una scoperta che mi ha lasciato davvero a bocca aperta e che potrebbe cambiare le carte in tavola nella lotta contro uno dei tumori più diffusi, quello del colon-retto. Immaginate la radioterapia: un’arma potente, un vero e proprio bombardamento mirato contro le cellule tumorali. Sappiamo che funziona danneggiando il DNA delle cellule maligne, spingendole verso la morte (l’apoptosi, per i più tecnici) e, cosa importantissima, attivando il nostro sistema immunitario. In particolare, stimola un percorso chiamato cGAS-STING, che è come un sensore d’allarme per il DNA anomalo presente nel citoplasma delle cellule. Una volta attivato, questo sistema scatena una risposta immunitaria anti-tumorale. Fantastico, no? Beh, non sempre.
Un Nemico Insidioso: La Resistenza alla Radioterapia
Purtroppo, come spesso accade in medicina e soprattutto in oncologia, c’è un “ma”. Molti tumori, incluso quello del colon-retto, sviluppano una resistenza alla radioterapia. È una sfida enorme, perché vanifica gli sforzi e riduce le speranze di guarigione. Capire perché e come questo accada è fondamentale per trovare nuove strategie terapeutiche. Ed è qui che entra in gioco la nostra ricerca, che ha scovato un colpevole inaspettato: il colesterolo.
Sì, avete capito bene. Proprio lui, il grasso di cui sentiamo parlare spesso in relazione alla dieta e alle malattie cardiovascolari. Sembra che la radioterapia, nel tentativo di distruggere il tumore, inneschi involontariamente un aumento della produzione di colesterolo all’interno delle cellule tumorali stesse. E questo, amici miei, è un bel problema.
Quando la Cura Causa un Problema Inatteso
Ma come succede? Abbiamo scoperto che i livelli di un enzima chiamato HMGCR (3-idrossi-3-metilglutaril-CoA reduttasi, un nome da sciogliere la lingua, lo so!) aumentano rapidamente dopo l’irradiazione. Questo enzima è un po’ il “capo cantiere” nella fabbrica del colesterolo cellulare. Più HMGCR c’è, più colesterolo viene prodotto. E cosa fa tutto questo colesterolo in eccesso? Ecco il punto cruciale.
Questo surplus di colesterolo va a “sequestrare” la proteina STING, che è una componente chiave del famoso percorso cGAS-STING. Immaginate STING come un messaggero che deve correre dal reticolo endoplasmatico (una parte della cellula) al complesso di Golgi (un’altra parte) per dare l’allarme. Il colesterolo, in pratica, gli mette i bastoni tra le ruote, bloccandolo nel reticolo endoplasmatico. Risultato? L’allarme non parte, la cascata di segnali che dovrebbe portare alla produzione di interferoni (sostanze che attivano le difese immunitarie) si interrompe, e il tumore riesce a sfuggire più facilmente all’attacco del sistema immunitario.
Abbiamo analizzato dati clinici e, purtroppo, le nostre scoperte in laboratorio trovano un triste riscontro nella realtà dei pazienti. Livelli elevati di HMGCR e di colesterolo sono stati correlati con una prognosi peggiore e una ridotta risposta alla radioterapia nei pazienti con cancro del colon-retto. Insomma, il tumore sembra sfruttare questo meccanismo a proprio vantaggio per resistere alle cure.
I Dati Clinici Non Mentono
Approfondendo l’analisi, abbiamo notato che alti livelli di HMGCR sono associati a una minore presenza di cellule T CD8+ nel tumore. Queste cellule sono i “soldati scelti” del nostro sistema immunitario, capaci di riconoscere e distruggere le cellule cancerose. Se il colesterolo ostacola la loro azione o il loro arrivo sul campo di battaglia, è chiaro che l’efficacia della radioterapia viene compromessa. Esperimenti di co-coltura, in cui abbiamo messo a contatto cellule tumorali e cellule immunitarie, hanno confermato che il colesterolo inibisce l’uccisione delle cellule tumorali mediata dalle cellule immunitarie, in particolare dalle CD8+ T cells. Questo effetto, per fortuna, poteva essere invertito se riducevamo il colesterolo intracellulare.
La radioterapia, come detto, induce il rilascio di DNA a doppio filamento (dsDNA) che attiva la via cGAS-STING. Abbiamo verificato che il colesterolo non impedisce il rilascio di dsDNA, né l’attivazione di cGAS, la prima proteina della catena. Il problema sorge proprio a livello di STING: il colesterolo ne riduce significativamente la fosforilazione (un processo chimico necessario per la sua attivazione), confermando il suo ruolo di “sabotatore” del trasporto di STING dal reticolo endoplasmatico al Golgi.
Una Vecchia Conoscenza Potrebbe Essere la Chiave
A questo punto, la domanda sorge spontanea: se il problema è l’eccesso di colesterolo indotto dalla radioterapia, non potremmo bloccarne la produzione? E qui entrano in gioco le statine, farmaci comunemente usati per abbassare i livelli di colesterolo nel sangue, che agiscono proprio inibendo l’enzima HMGCR. Abbiamo pensato: e se combinassimo la radioterapia con una statina, ad esempio la lovastatina?
L’idea era semplice ma, secondo noi, potente: la radioterapia fa il suo lavoro di danneggiare il tumore, mentre la statina impedisce al tumore di “difendersi” aumentando la produzione di colesterolo e bloccando la risposta immunitaria. In questo modo, speravamo di ripristinare e potenziare l’attivazione della via cGAS-STING e, di conseguenza, la risposta anti-tumorale.
Dalla Teoria alla Pratica: Gli Studi Sugli Animali
Abbiamo quindi testato questa strategia su modelli animali di cancro del colon-retto. I risultati sono stati entusiasmanti! La lovastatina da sola non aveva un grande effetto anti-tumorale. Ma quando l’abbiamo combinata con la radioterapia, la crescita del tumore è stata significativamente attenuata. Il peso medio del tumore nei topi trattati con la terapia combinata era circa un quarto rispetto a quelli trattati solo con radioterapia, e questo senza una significativa perdita di peso corporeo negli animali, indicando una buona tollerabilità.
Le analisi sui tessuti tumorali hanno mostrato un aumento della necrosi (morte cellulare), una riduzione della proliferazione delle cellule tumorali e un incremento dell’apoptosi nel gruppo che riceveva la terapia combinata. Ma non è tutto. Abbiamo fatto anche un esperimento di “rechallenge”: dopo aver rimosso il tumore iniziale trattato, abbiamo provato a impiantare nuove cellule tumorali sull’altro fianco degli stessi topi. Ebbene, nei topi che avevano ricevuto la terapia combinata, i nuovi tumori crescevano molto più lentamente, suggerendo che questa strategia induce una memoria immunitaria a lungo termine! E, cosa fondamentale, non abbiamo osservato tossicità aggiuntiva significativa a carico degli organi principali.
Un Duo Potente: Radioterapia e Statine Insieme
Per capire meglio cosa succedesse a livello molecolare e cellulare nel microambiente tumorale, abbiamo eseguito analisi di RNA-sequencing. Queste analisi ci hanno rivelato che la terapia combinata portava a un aumento significativo dell’espressione di geni legati alla citotossicità immunitaria (come Granzima B, Perforina-1, Interferone-gamma) e di chemochine (sostanze che attirano le cellule immunitarie). In pratica, il microambiente tumorale diventava molto più “caldo” e ostile per il cancro.
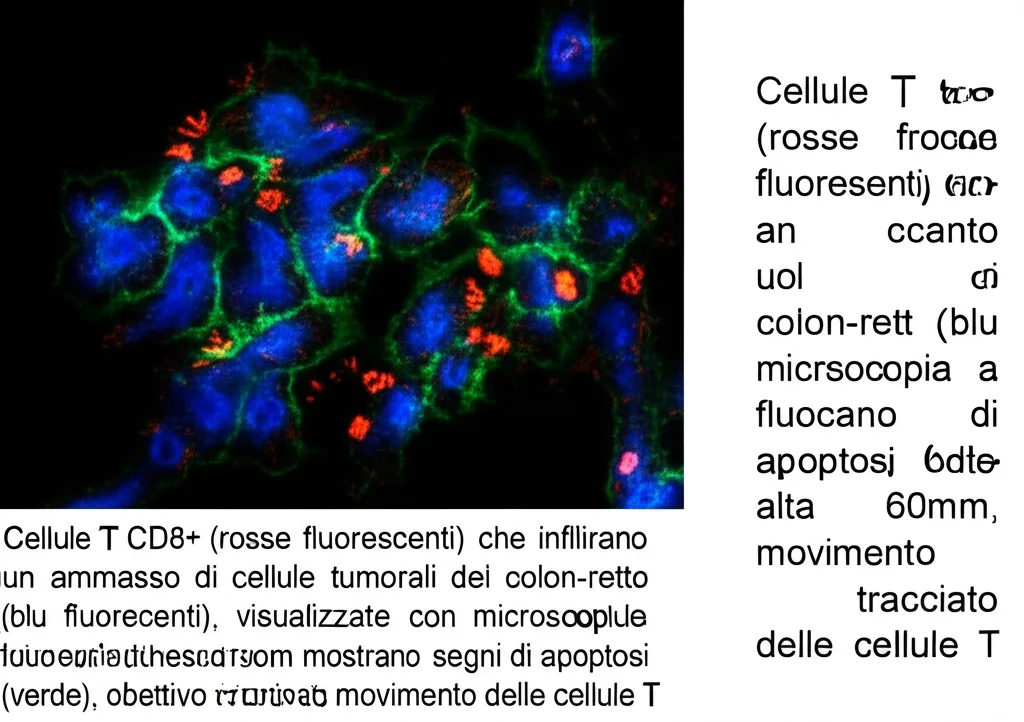
Le analisi di citometria a flusso hanno confermato un aumento dell’infiltrazione di cellule T CD3+ e, specificamente, un notevole incremento della proporzione di cellule T CD8+ nel gruppo della terapia combinata. Non solo erano più numerose, ma queste cellule T CD8+ producevano anche più Interferone-gamma, segno di una loro maggiore attivazione e funzionalità citotossica. Queste osservazioni sono state ulteriormente validate con tecniche di immunofluorescenza e immunoistochimica.
Fondamentalmente, la lovastatina, bloccando la produzione di colesterolo, permetteva alla via cGAS-STING di attivarsi pienamente in risposta ai danni indotti dalla radioterapia. Questo si traduceva in una maggiore produzione di interferoni di tipo I e altre citochine, che a loro volta richiamavano e attivavano le cellule T CD8+ killer. Per confermare ulteriormente il ruolo cruciale di cGAS-STING e delle cellule T CD8+, abbiamo fatto altri esperimenti. Usando un inibitore di STING (C-176), abbiamo visto che l’effetto benefico della combinazione radioterapia-lovastatina veniva parzialmente annullato. Allo stesso modo, in topi geneticamente privi di cellule T CD8+ (CD8-KO), l’effetto sinergico della terapia combinata era significativamente ridotto.
Cosa Ci Riserva il Futuro?
Certo, come ogni studio, anche il nostro ha delle limitazioni. Ad esempio, non abbiamo ancora chiarito ogni singolo dettaglio di come il colesterolo regoli precisamente la via cGAS-STING o come la lovastatina influenzi altre cellule immunitarie nel microambiente tumorale. Questi sono aspetti che meritano ulteriori indagini.
Tuttavia, credo che i nostri risultati aprano una strada davvero promettente. L’idea di combinare la radioterapia con le statine, farmaci già ampiamente utilizzati, sicuri e relativamente poco costosi, per trattare il cancro del colon-retto (e potenzialmente altri tumori solidi) è estremamente allettante. Potrebbe essere una strategia per superare la resistenza alla radioterapia e migliorare l’efficacia delle cure esistenti, sfruttando e potenziando la capacità del nostro stesso sistema immunitario di combattere il cancro.
Un Messaggio di Speranza
In conclusione, abbiamo scoperto che la radioterapia, pur essendo un trattamento fondamentale, può innescare un aumento della sintesi di colesterolo nelle cellule tumorali. Questo colesterolo in eccesso, a sua volta, inibisce la via cGAS-STING, un meccanismo cruciale per la risposta immunitaria anti-tumorale, contribuendo così alla resistenza al trattamento. La buona notizia è che inibendo la sintesi di colesterolo con le statine, come la lovastatina, possiamo “sbloccare” questa via immunitaria, potenziando l’efficacia della radioterapia e l’infiltrazione e la funzione delle cellule T CD8+ killer. È un esempio affascinante di come, studiando a fondo i meccanismi biologici, possiamo trovare nuove strategie per combattere malattie complesse come il cancro. Speriamo che questi risultati gettino le basi per futuri studi clinici che possano confermare l’efficacia di questo approccio combinato nei pazienti.
Grazie per avermi seguito in questo viaggio scientifico! Spero di avervi trasmesso un po’ dell’entusiasmo che queste scoperte generano in noi ricercatori.
Fonte: Springer