Cancro Esofageo: La Scommessa Vinta di Radiomica e Infiammazione per Prevedere il Futuro!
Amici della scienza e della medicina, oggi vi porto in un viaggio affascinante nel cuore della ricerca oncologica, un campo dove ogni piccolo passo avanti può significare una speranza in più per i pazienti. Parleremo di una sfida non da poco: il carcinoma squamoso dell’esofago (ESCC), un tipo di tumore che, purtroppo, tende a dare del filo da torcere con metastasi precoci ai linfonodi e una prognosi spesso severa. Ma non temete, perché la scienza non dorme mai e oggi vi racconto di un approccio innovativo che sta aprendo nuove prospettive!
Il Nemico Silenzioso: Il Carcinoma Squamoso dell’Esofago (ESCC)
Quando parliamo di ESCC resecabile, cioè operabile, la chirurgia è ancora la strada maestra, specialmente nelle fasi iniziali e intermedie. L’obiettivo è chiaro: rimuovere il tumore radicalmente. Tuttavia, il vero spauracchio sono le recidive post-operatorie e le metastasi, che purtroppo peggiorano drasticamente la prognosi. Immaginate la frustrazione: si affronta un intervento importante, si pensa di aver vinto la battaglia, e poi il nemico si ripresenta. È qui che medici e pazienti si chiedono: come possiamo prevedere chi è più a rischio e migliorare la sopravvivenza libera da progressione (PFS) e quella globale (OS)?
Certo, abbiamo dei fattori prognostici noti come lo stadio patologico, la presenza di metastasi linfonodali, l’invasione perineurale o vascolare. Ma il sistema di stadiazione TNM (Tumore, Nodi, Metastasi), pur essendo fondamentale, a volte non basta. È come guardare una foto e cercare di capire l’intera storia di una persona: utile, ma limitato. Non riesce a cogliere l’effetto combinato di tanti piccoli dettagli che, insieme, fanno la differenza. Serve qualcosa di più, una visione più personalizzata.
L’Infiammazione: Un Alleato Nascosto del Tumore?
Negli ultimi anni, abbiamo capito sempre meglio che il tumore non è un’entità isolata, ma interagisce profondamente con l’organismo che lo ospita. Una delle interazioni più studiate è l’infiammazione sistemica. Avete presente quando vi fate male e la zona si gonfia e diventa rossa? Ecco, quella è un’infiammazione, una risposta del corpo. Nel caso dei tumori, però, un’infiammazione cronica può giocare un ruolo decisivo nell’insorgenza, progressione, metastatizzazione e persino nella resistenza alle terapie. Un elevato carico infiammatorio, insomma, spesso si associa a una prognosi peggiore.
Indicatori infiammatori semplici, che possiamo misurare con un banale esame del sangue, come il rapporto neutrofili-linfociti (NLR) e il rapporto piastrine-linfociti (PLR), si sono già dimostrati utili nel predire la prognosi del cancro esofageo. E poi c’è l’indice di infiammazione immunitaria sistemica (SII), che combina neutrofili, piastrine e linfociti, offrendo un quadro ancora più completo della relazione tra infiammazione indotta dal tumore e risposta immunitaria anti-tumorale. Anche questo si è rivelato prezioso per i tumori solidi.
La Radiomica: Leggere Oltre le Immagini TAC
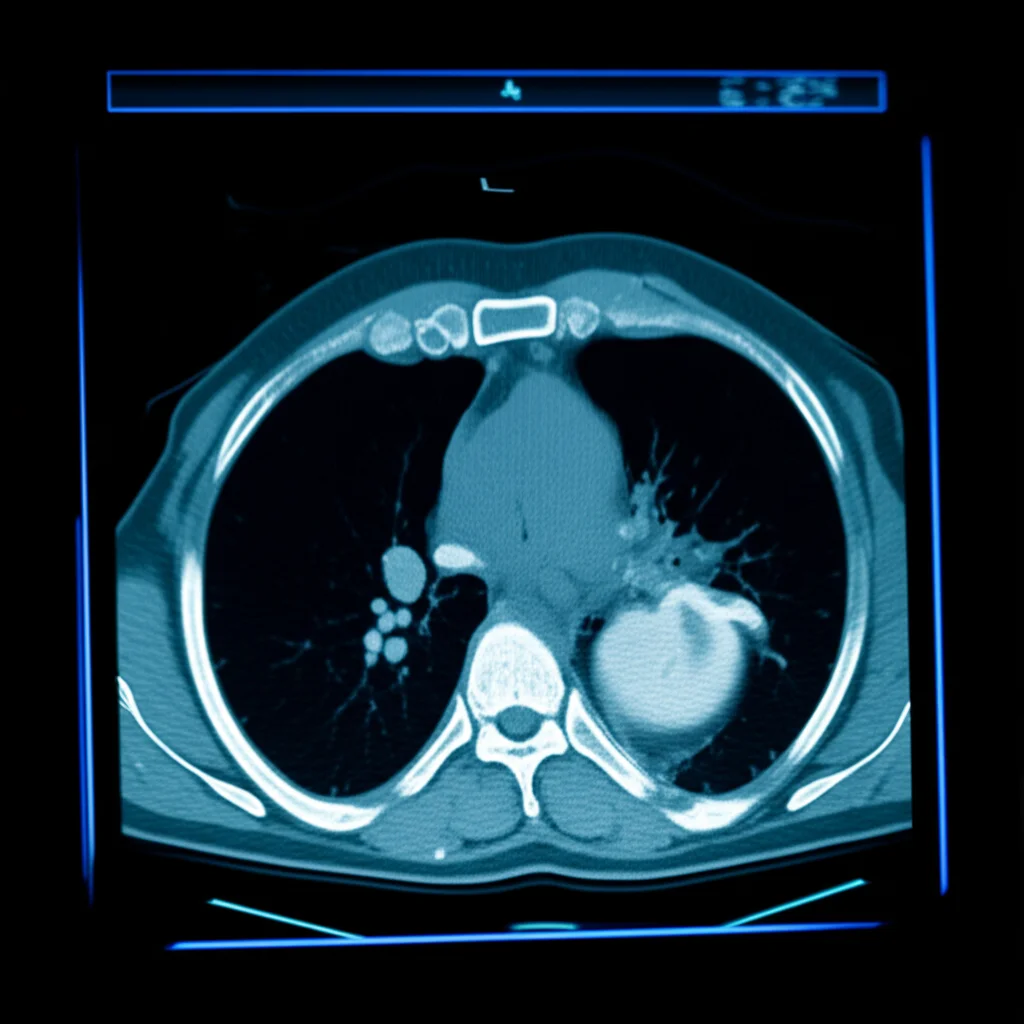
E se vi dicessi che anche le immagini mediche, come una comune TAC, nascondono un tesoro di informazioni che va ben oltre ciò che l’occhio umano può cogliere a prima vista? Benvenuti nel mondo della radiomica! Questa disciplina è una sorta di “archeologia digitale” delle immagini mediche. Estrae una miriade di dati quantitativi, sia morfologici che funzionali, dalle immagini. Poi, con algoritmi sofisticati, seleziona e analizza le caratteristiche più rilevanti, mettendole in correlazione con esiti clinici come la risposta al trattamento o i tassi di sopravvivenza. Un vero e proprio strumento di precisione per la diagnosi e la terapia.
Diversi studi hanno già dimostrato che le caratteristiche radiomiche, oggettive e quantitative, possono fungere da biomarcatori prognostici per immagini. La radiomica è stata applicata con successo in molti aspetti della valutazione clinica dei tumori, dalla diagnosi alla predizione dell’efficacia terapeutica e della prognosi. E la TAC, in particolare, ha un valore clinico enorme nella stadiazione preoperatoria, nella valutazione della resecabilità e nel monitoraggio dell’effetto curativo del cancro esofageo. Alcuni ricercatori, ad esempio, hanno già usato la radiomica per prevedere la risposta patologica completa dopo chemioimmunoterapia neoadiuvante nell’ESCC, aiutando nelle decisioni cliniche. Pensate, un modello che combina radiomica, fattori ematologici e caratteristiche clinicopatologiche ha raggiunto un’accuratezza predittiva notevole!
Finora, però, pochi si erano concentrati sull’usare un nomogramma clinico-radiomico per predire la sopravvivenza libera da progressione a 5 anni nell’ESCC. Ed è proprio qui che entra in gioco lo studio che vi sto raccontando.
La Nostra Missione: Sviluppare un Modello Predittivo Super-Potente
L’obiettivo era ambizioso: sviluppare un modello nomografico individualizzato che combinasse gli indicatori infiammatori clinici e le caratteristiche radiomiche della TAC per predire la PFS a 5 anni dopo l’intervento chirurgico radicale per ESCC. In pratica, uno strumento per identificare precocemente i pazienti con una prognosi potenzialmente sfavorevole.
Per farlo, abbiamo analizzato retrospettivamente i dati di 258 pazienti operati tra il luglio 2017 e il marzo 2019. Abbiamo raccolto una marea di informazioni: dati clinici, risultati di laboratorio (compresi i nostri amati indicatori infiammatori come LMR, NLR, PLR e SII, misurati prima dell’intervento), referti patologici, dati delle TAC preoperatorie e, ovviamente, gli esiti di sopravvivenza. I pazienti sono stati poi divisi casualmente in un gruppo di addestramento (180 pazienti) e uno di test (78 pazienti), un po’ come si fa quando si insegna a un’intelligenza artificiale.
Dalle immagini TAC, acquisite con protocolli standardizzati, abbiamo segmentato manualmente le lesioni tumorali. Immaginate due radiologi esperti che, strato dopo strato, delineano il tumore in 3D, includendo l’intera lesione ma evitando i tessuti sani circostanti. Un lavoro certosino! Da queste regioni di interesse (ROI), abbiamo estratto ben 1316 caratteristiche radiomiche utilizzando un software open-source basato su Pyradiomics. Queste caratteristiche descrivono la forma del tumore, l’intensità dei pixel (caratteristiche di primo ordine) e la “texture” (come la matrice di co-occorrenza dei livelli di grigio, GLCM, o la matrice delle dimensioni delle zone di livello di grigio, GLSZM).
Poi è iniziata la “selezione naturale”:
- Abbiamo normalizzato i dati.
- Abbiamo verificato la riproducibilità delle features, tenendo solo quelle con un’alta concordanza tra i due radiologi (ICC > 0.90).
- Abbiamo usato algoritmi come MRMR (maximal relevance and minimal redundancy) e la regressione LASSO-Cox per ridurre ulteriormente il numero di features, mantenendo solo le più informative e meno ridondanti. Alla fine, ne sono rimaste 15!
Con queste 15 “super-features” abbiamo calcolato un Rad-score (punteggio radiomico) per ogni paziente e sviluppato un modello radiomico. Parallelamente, abbiamo selezionato gli indicatori infiammatori più significativi (LMR, PLR, SII) e costruito un modello infiammatorio.
I Risultati Che Ci Hanno Entusiasmato!
Ebbene, sia il modello infiammatorio che quello radiomico hanno mostrato una buona efficacia predittiva per la PFS, sia nel gruppo di addestramento che in quello di test. Ma la vera magia è avvenuta quando abbiamo combinato il tutto in un modello nomografico che includeva LMR, PLR, SII e il Rad-score.
I numeri parlano chiaro:
- L’AUC (Area Under the Curve), che misura la capacità discriminatoria del modello (più è vicino a 1, meglio è), per il modello nomografico è stata di 0.964 nel training set e 0.958 nel test set. Valori decisamente superiori a quelli dei modelli singoli!
- Anche l’indice C (C-index), che valuta l’accuratezza, è stato eccellente: 0.896 nel training set e 0.893 nel test set.
Il test di DeLong ha confermato che le differenze tra il modello nomografico e i modelli singoli erano statisticamente significative. Anche l’analisi delle curve di decisione (DCA) ha rivelato che il beneficio clinico netto del modello nomografico era superiore. In pratica, questo nuovo strumento è più bravo a “indovinare” chi andrà bene e chi no.
Le curve di Kaplan-Meier, poi, hanno mostrato una differenza significativa nella PFS tra i gruppi ad alto e basso rischio identificati sia dal Rad-score che dal modello nomografico. I pazienti nel gruppo ad alto rischio avevano, come previsto, una maggiore probabilità di recidiva postoperatoria e una PFS peggiore.
Perché Insieme è Meglio: La Sinergia tra Radiomica e Infiammazione
Ma perché questa combinazione funziona così bene? Pensateci: le caratteristiche radiomiche ci danno una descrizione quantitativa della distribuzione dell’intensità dei pixel del tumore, della sua eterogeneità. Le features wavelet, ad esempio, che sono risultate molto importanti nel nostro studio (ben 10 su 15!), catturano informazioni multi-frequenza da più dimensioni del tumore, offrendo uno sguardo più profondo sulla sua eterogeneità. Alcune features di primo ordine, come la mediana e la curtosi, o i percentili 10° e 90°, possono essere legate alla densità e struttura dei microvasi tumorali, e quindi all’aggressività.
Dall’altra parte, gli indicatori infiammatori (LMR basso, PLR basso e SII alto associati a prognosi peggiore nel nostro studio) riflettono l’ambiente sistemico in cui il tumore cresce. Le cellule infiammatorie come neutrofili, linfociti, monociti e piastrine influenzano la progressione tumorale attraverso meccanismi complessi: i neutrofili possono promuovere l’angiogenesi e sopprimere la risposta immunitaria, una diminuzione dei linfociti indebolisce le difese, i monociti possono differenziarsi in macrofagi associati al tumore, e le piastrine possono stimolare la tumorigenesi e le metastasi.
C’è una correlazione profonda: la crescita tumorale dipende da un microambiente infiammatorio. L’angiogenesi tumorale è legata all’infiammazione. L’invasione e le metastasi sono promosse da fattori infiammatori. Quindi, analizzare insieme le caratteristiche radiomiche del tumore e gli indicatori infiammatori sistemici ci permette di avere un quadro molto più completo e accurato. È come mettere insieme due detective molto bravi, ognuno con le sue specialità, per risolvere un caso complesso.
Non Ci Fermiamo Qui: Limiti e Prospettive Future
Certo, come ogni studio, anche il nostro ha delle limitazioni. Innanzitutto, la peristalsi esofagea potrebbe introdurre variazioni nelle features radiomiche, e la delineazione manuale del tumore, per quanto accurata, ha una sua soggettività. Inoltre, lo studio è retrospettivo e manca una validazione esterna su un’altra coorte di pazienti, magari di altri centri. Sarebbe fantastico, in futuro, includere anche features genomiche, che potrebbero spiegare ulteriormente le differenze individuali nella prognosi.
Nonostante ciò, i risultati sono davvero promettenti. Abbiamo proposto un nuovo indicatore prognostico non invasivo basato sulle caratteristiche radiomiche della TAC potenziata da contrasto, che migliora la capacità di predizione prognostica per l’ESCC. Il modello nomografico che abbiamo sviluppato, combinando indicatori infiammatori e features radiomiche, ha diviso con successo i pazienti in gruppi ad alto e basso rischio.
Un Passo Avanti per la Medicina Personalizzata
Questo è un aiuto enorme per la stratificazione del rischio, il monitoraggio del tumore e il follow-up. Offre un valore importante per un trattamento sempre più preciso e personalizzato dei pazienti con ESCC. Dà ai medici l’opportunità di formulare strategie su misura per migliorare la prognosi dei loro pazienti. Immaginate di poter dire a un paziente, con maggiore sicurezza, qual è il suo rischio individuale e pianificare di conseguenza controlli più stretti o terapie adiuvanti più mirate. È un passo avanti significativo verso una medicina che non cura solo la malattia, ma la persona nella sua unicità. E questo, credetemi, è ciò che ci spinge a continuare la ricerca ogni singolo giorno!
Fonte: Springer