Radiomica degli Habitat: La Nuova Frontiera per Smascherare le Metastasi Nascoste nel Cancro Testa-Collo
Ciao a tutti! Oggi voglio parlarvi di qualcosa di veramente affascinante che sta cambiando il modo in cui affrontiamo una delle sfide più grandi in oncologia: il cancro della testa e del collo, o HNSCC (Head and Neck Squamous Cell Carcinoma), e in particolare le sue subdole metastasi nascoste. Immaginate di poter “vedere” dentro il tumore con un dettaglio incredibile, non solo la sua forma, ma anche le sue caratteristiche più nascoste, quelle che ci dicono se è probabile che si diffonda ai linfonodi vicini, anche quando le normali scansioni sembrano dire di no. Sembra fantascienza? Beh, non proprio. Si chiama radiomica, e in particolare, una sua evoluzione chiamata radiomica degli habitat.
Il Dilemma delle Metastasi Linfonodali Occulte (LNM)
Partiamo dal problema. L’HNSCC è un tipo di tumore piuttosto aggressivo, noto per la sua tendenza a invadere i tessuti circostanti e a dare metastasi, specialmente ai linfonodi del collo (LNM). Sapere se i linfonodi sono coinvolti è fondamentale per decidere la terapia migliore e per capire le possibilità di guarigione del paziente.
Il guaio è che a volte, anche se le immagini diagnostiche (come TAC, Risonanza Magnetica, Ecografia) non mostrano segni evidenti di metastasi nei linfonodi (questi pazienti vengono classificati come cN0, cioè clinicamente senza coinvolgimento linfonodale), in realtà le metastasi ci sono. Sono “occulte”, nascoste. Si stima che circa il 30-40% dei pazienti cN0 abbia in realtà delle micro-metastasi che vengono scoperte solo dopo l’intervento chirurgico, analizzando i linfonodi asportati.
Questo crea un bel dilemma per i medici: operare preventivamente tutti i linfonodi del collo (dissezione linfonodale profilattica) per sicurezza? Questo approccio, sebbene riduca il rischio di lasciare indietro metastasi occulte, significa anche che oltre il 70% dei pazienti subisce un intervento invasivo e non necessario, con possibili complicazioni. D’altra parte, aspettare e non fare nulla può essere troppo rischioso. Anche la PET-CT, pur essendo molto sensibile, a volte dà falsi positivi a causa di infiammazioni o infezioni. E i biomarcatori molecolari, sebbene promettenti, non sono ancora pronti per l’uso clinico su larga scala. Insomma, trovare il giusto equilibrio è una vera sfida.
La Radiomica: Estrarre Oro dalle Immagini Mediche
Ed è qui che entra in gioco la radiomica. Cos’è esattamente? Immaginate le immagini mediche (come una TAC) non solo come fotografie, ma come miniere di dati digitali. La radiomica utilizza algoritmi sofisticati per estrarre da queste immagini una quantità enorme di informazioni quantitative, invisibili all’occhio umano. Parliamo di centinaia, a volte migliaia, di “features” (caratteristiche) che descrivono la forma, la texture, l’intensità dei pixel all’interno del tumore e molto altro. L’idea è che queste features possano riflettere la biologia sottostante del tumore, la sua aggressività, la sua eterogeneità.
Un Passo Avanti: La Radiomica degli “Habitat” Tumorali
Ma c’è di più. Un tumore non è una massa uniforme. Al suo interno esistono diverse “zone” o “habitat” con caratteristiche biologiche differenti: aree più vascolarizzate, aree necrotiche (morte), aree con diverse densità cellulari. Analizzare il tumore nel suo complesso potrebbe dare una visione media, ma forse poco rappresentativa della sua vera natura eterogenea.
La radiomica degli habitat fa proprio questo: prima divide il tumore in sotto-regioni biologicamente simili, basandosi sulle caratteristiche radiomiche di ogni singolo voxel (il “pixel” tridimensionale dell’immagine). Poi, analizza le features radiomiche specifiche di ogni habitat, oltre a quelle della regione puramente interna (intratumorale) e di quella immediatamente circostante (peritumorale). È come studiare una città analizzando i suoi singoli quartieri, ognuno con la sua identità, invece di limitarsi a guardare la media dell’intera metropoli.

Lo Studio: Mettere alla Prova la Radiomica degli Habitat
Nel nostro studio, abbiamo voluto verificare se questo approccio “habitat” fosse davvero più efficace nel predire le famigerate metastasi linfonodali occulte (occult LNM) nell’HNSCC. Abbiamo raccolto dati da ben tre centri medici diversi, più dati dal Cancer Genome Atlas (TCGA), per un totale di centinaia di pazienti. Abbiamo diviso i pazienti in set di training (per “allenare” i modelli) e set di test (interni ed esterni, per verificare se i modelli funzionavano anche su dati nuovi e diversi).
Abbiamo estratto le features radiomiche dalle regioni intratumorali, peritumorali (considerando un sottile bordo di 1 mm attorno al tumore, che si è rivelato ottimale) e dagli “habitat” tumorali (identificati automaticamente con un algoritmo di clustering chiamato K-means, che ha individuato 3 habitat principali). Poi, abbiamo usato diversi classificatori di machine learning (Regressione Logistica – LR, Support Vector Machine – SVM, e Random Forest – RF) per costruire nove modelli predittivi diversi (uno per ogni combinazione regione/classificatore).
Il Campione: Il Modello RF-Habitat
E il vincitore è stato… il modello basato sulla Random Forest (RF) applicato alle features degli habitat (RF-habitat)! Questo modello ha mostrato le performance migliori in assoluto su tutti i set di dati, con un’accuratezza predittiva (misurata dall’AUC, Area Under the Curve) davvero notevole, tra 0.835 e 0.919. Questo significa che è molto bravo a distinguere i pazienti cN0 che hanno metastasi occulte da quelli che non le hanno.
Abbiamo anche creato un modello “ibrido”, combinando il punteggio del modello RF-habitat con alcuni dati clinici e radiologici significativi (come il diametro massimo del tumore e il grado istologico). Sia il modello RF-habitat da solo che il modello ibrido si sono dimostrati significativamente superiori a un modello basato solo sui dati clinico-radiologici tradizionali.
Non Solo Predizione, Ma Anche Prognosi
Ma non ci siamo fermati qui. Abbiamo verificato se il nostro modello RF-habitat fosse utile anche per predire l’andamento della malattia nel tempo. Abbiamo seguito i pazienti per 3 anni, guardando la sopravvivenza libera da malattia (DFS) e la sopravvivenza globale (OS). Ebbene sì: i pazienti classificati come “ad alto rischio” dal nostro modello avevano tassi di DFS e OS significativamente più bassi rispetto a quelli a “basso rischio”, in tutti i gruppi di pazienti analizzati. Questo suggerisce che la radiomica degli habitat non solo identifica le metastasi occulte, ma cattura anche qualcosa sull’aggressività biologica del tumore che si riflette sulla prognosi a lungo termine.
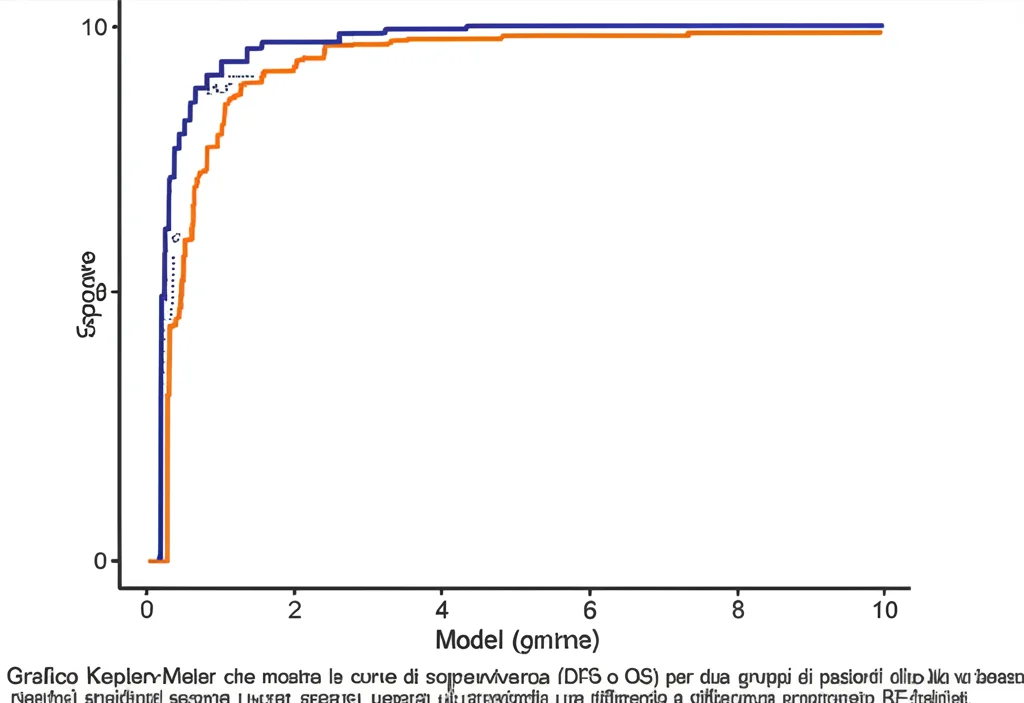
Sotto il Cofano: Il Legame con il Microambiente Immunitario
La domanda successiva era: perché questo modello funziona così bene? Cosa “vede” nelle immagini che è legato alla capacità del tumore di dare metastasi nascoste? Per capirlo, abbiamo fatto un passo ulteriore, entrando nel campo della radiogenomica. Abbiamo analizzato i dati di espressione genica (RNA sequencing) di alcuni pazienti, sia a livello “bulk” (tutto il tessuto tumorale insieme) sia a livello di singola cellula (single-cell RNA sequencing).
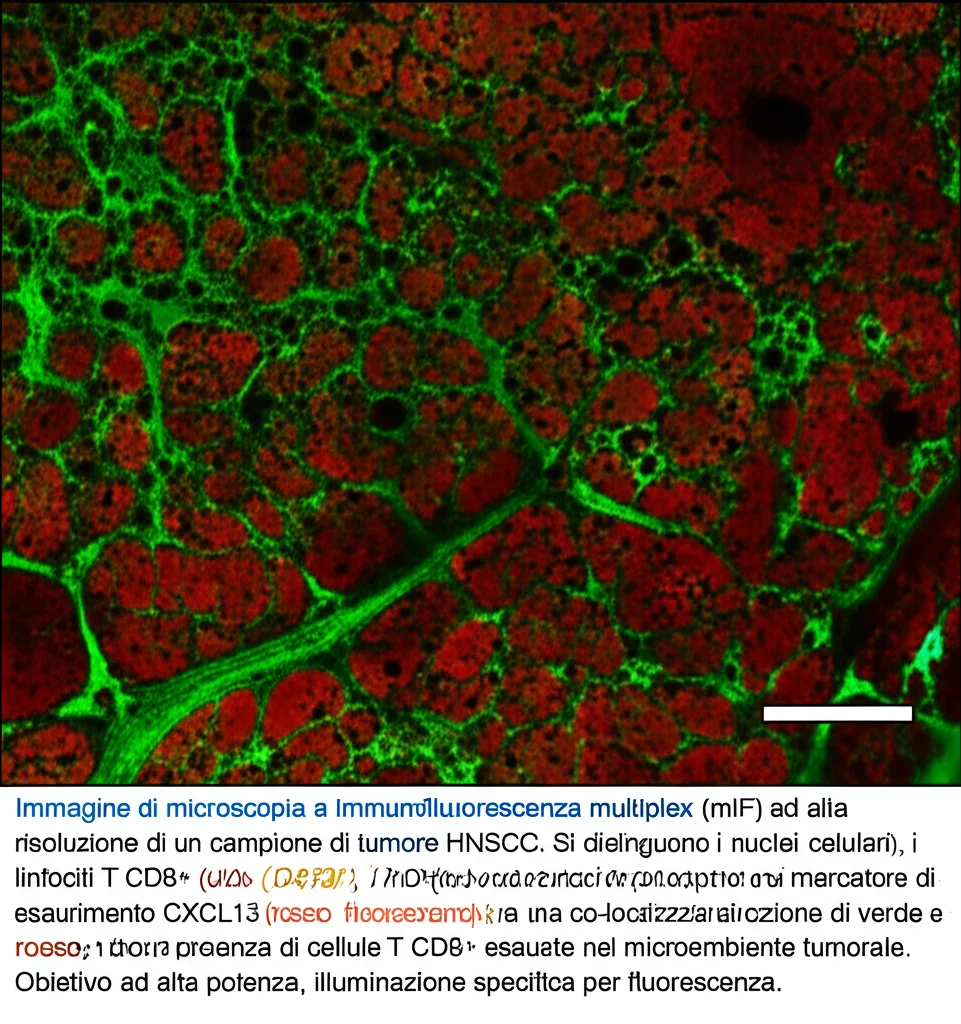
I risultati sono stati illuminanti! Abbiamo scoperto che il punteggio del modello RF-habitat è fortemente associato a specifiche caratteristiche del microambiente immunitario del tumore. In particolare, i pazienti classificati come “ad alto rischio” dal modello mostravano un arricchimento di percorsi legati alla regolazione immunitaria e, cosa ancora più interessante, un’abbondanza maggiore di un tipo specifico di cellule immunitarie: i linfociti T CD8+ “esausti” (marcati dal gene CXCL13).
Cosa significa? I linfociti T CD8+ sono normalmente i nostri “soldati” principali contro il cancro. Ma nel microambiente tumorale, a causa di stimoli continui e segnali immunosoppressivi, possono diventare “esausti”, perdendo la loro capacità di attaccare e uccidere le cellule tumorali. La presenza di questi T CD8+ esausti è associata a una peggiore risposta immunitaria e, come suggerisce il nostro studio, potrebbe essere un fattore chiave che favorisce la formazione di metastasi occulte. La radiomica degli habitat sembra essere in grado di “catturare” indirettamente questi segnali di disfunzione immunitaria direttamente dalle immagini TAC! Abbiamo anche confermato questa maggiore presenza di cellule T CD8+ esauste nei tumori metastatici usando una tecnica chiamata immunofluorescenza multiplex (mIF).
Cosa Significa Tutto Questo per il Futuro?
Questi risultati sono davvero promettenti. Avere un modello non invasivo, basato su una semplice TAC con mezzo di contrasto (un esame di routine), che possa predire con alta accuratezza la presenza di metastasi linfonodali occulte nell’HNSCC potrebbe davvero cambiare la gestione clinica di questi pazienti. Potrebbe aiutarci a selezionare meglio chi ha davvero bisogno di una dissezione linfonodale profilattica, risparmiando a molti altri un intervento non necessario.
Inoltre, il collegamento scoperto con l’esaurimento delle cellule T CD8+ apre nuove prospettive. Non solo ci aiuta a capire meglio la biologia dietro le metastasi occulte, ma potrebbe anche suggerire nuove strategie terapeutiche, magari combinando la radiomica per identificare i pazienti a rischio con immunoterapie mirate a “risvegliare” le cellule T esauste.
Certo, ci sono ancora dei limiti. Lo studio è retrospettivo, quindi serviranno studi prospettici multicentrici per confermare questi risultati su larga scala prima di poter portare questi modelli nella pratica clinica quotidiana. E sarebbe fantastico poter correlare direttamente gli “habitat” radiomici con le analisi patologiche specifiche di quelle aree.
Ma la strada è tracciata. La radiomica degli habitat si sta dimostrando uno strumento potentissimo, capace non solo di predire eventi clinici importanti come le metastasi occulte, ma anche di svelarci indizi preziosi sulla complessa biologia del tumore e sulla sua interazione con il sistema immunitario, tutto partendo da una “semplice” immagine medica. È un campo in rapidissima evoluzione, e sono convinto che ne sentiremo parlare sempre di più!
Fonte: Springer

![Visualizzazione 3D di una molecola di radioligando [68Ga]Ga-BiFAPI che si lega specificamente alla proteina FAP sulla superficie di una cellula tumorale, con il Gallio-68 che emette positroni per l'imaging PET, sfondo astratto high-tech, obiettivo macro 80mm, alta definizione, illuminazione drammatica.](https://scienzachiara.it/wp-content/uploads/2025/05/163_visualizzazione-3d-di-una-molecola-di-radioligando-68gaga-bifapi-che-si-lega-specificamente-alla-proteina-fap-sulla-superficie-300x166.webp)