RAB23: Il Regista Nascosto del Traffico Cellulare che Modula la Nostra Comunicazione Interna!
Ciao a tutti, appassionati di scienza e curiosi della vita! Oggi voglio portarvi con me in un viaggio affascinante nel microscopico mondo delle nostre cellule. Immaginate le cellule come città frenetiche, con un traffico incessante di molecole che entrano, escono e si spostano al loro interno. Questo traffico, noto come traffico di membrana cellulare, è fondamentale per la vita stessa. E indovinate un po’? Esistono dei “vigili urbani” molecolari che dirigono questo caos organizzato. Uno di questi registi, di cui forse non avete mai sentito parlare ma che sta emergendo come una vera star, è una proteina chiamata RAB23.
Chi è RAB23 e perché dovrebbe interessarci?
RAB23 appartiene a una grande famiglia di proteine chiamate Rab-GTPasi. Pensate a loro come a degli interruttori molecolari: possono essere “accesi” (legati a una molecola chiamata GTP) o “spenti” (legati a GDP). Questo stato acceso/spento determina la loro funzione nel guidare la formazione, il trasporto e la fusione di piccole “bolle” chiamate vescicole, che sono i camioncini di consegna delle nostre cellule.
Sappiamo da tempo che RAB23 gioca un ruolo cruciale durante lo sviluppo embrionale, in particolare nella formazione di organi come il cuore, il tubo neurale e lo scheletro. Mutazioni nel gene RAB23 causano infatti una rara malattia genetica chiamata Sindrome di Carpenter, caratterizzata da difetti proprio in queste aree. Inoltre, studi precedenti, inclusi alcuni a cui ho avuto il piacere di contribuire, hanno mostrato come RAB23 influenzi la comunicazione tra cellule regolando importanti vie di segnalazione come quelle dei fattori di crescita FGF, Hedgehog (Hh), TGFβ e BMP. Ma c’era un pezzo mancante nel puzzle: come fa RAB23 a fare tutto questo a livello meccanicistico? Come si inserisce nel complesso ingranaggio del traffico vescicolare e come questo influenza la segnalazione? È proprio quello che abbiamo cercato di scoprire!
L’indagine: sulle tracce di RAB23 nel traffico cellulare
Per capire il ruolo di RAB23, dovevamo prima capire dove si trovasse esattamente all’interno della cellula e con quali altre proteine interagisse. Abbiamo usato cellule umane di osteosarcoma (MG-63) e cellule primarie derivate da topi.
1. Localizzazione: Dove lavora RAB23?
Utilizzando tecniche di microscopia confocale ad alta risoluzione, abbiamo “etichettato” RAB23 con un marcatore fluorescente (HA o GFP) e siamo andati a vedere dove si posizionava rispetto ad altri marcatori noti delle diverse “stazioni” del percorso endocitico (il processo con cui la cellula importa materiale dall’esterno).
I risultati sono stati illuminanti! Abbiamo visto che RAB23 si trovava spesso vicino a marcatori degli endosomi precoci (EEA1 e RAB5), le prime stazioni di smistamento dopo l’ingresso nella cellula. Ma non solo! Co-localizzava fortemente anche con marcatori degli endosomi tardivi (RAB7) e persino con marcatori dell’autofagia (LC3 A/B), un processo di “pulizia” cellulare. Questo suggerisce che RAB23 potrebbe essere coinvolto in diverse tappe del viaggio endocitico.
2. La via preferenziale: Clatrina sì, Caveolina meno
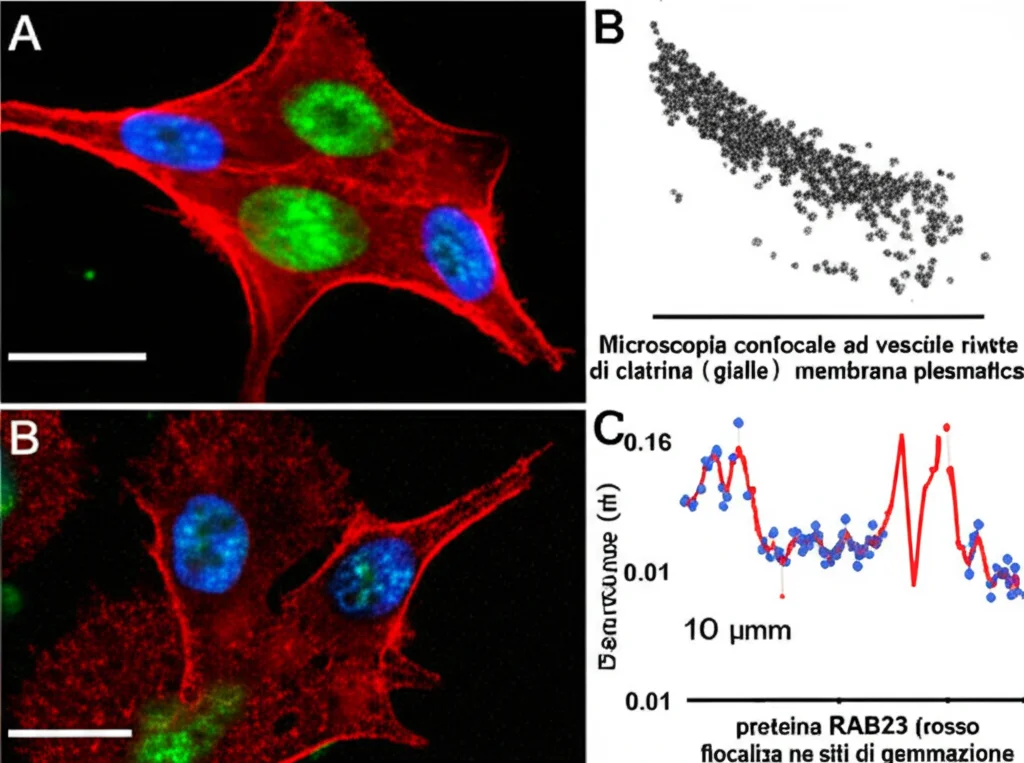
Esistono diverse “strade” per entrare nella cellula. Due delle principali sono la via dipendente dalla clatrina e quella dipendente dalla caveolina. La clatrina forma una sorta di “gabbia” attorno alla vescicola nascente. Abbiamo scoperto che RAB23 co-localizza molto bene con la clatrina, specialmente vicino alla membrana plasmatica (il confine esterno della cellula), ma molto meno con la caveolina. Questo ci ha indirizzato verso l’ipotesi che RAB23 operi principalmente nella via dell’endocitosi clatrina-dipendente.
I complici di RAB23: con chi collabora?
L’endocitosi clatrina-dipendente è un processo complesso che richiede molti attori. Al centro c’è il complesso proteico AP-2 (Adaptor Protein 2), che riconosce il “carico” da trasportare sulla membrana e recluta la clatrina. Immaginate AP-2 come il supervisore che decide cosa caricare sul camioncino (la vescicola) e la clatrina come il materiale per costruire il camioncino stesso.
Abbiamo fatto un’altra scoperta chiave: RAB23 interagisce direttamente con una subunità specifica di AP-2, chiamata β-adaptina (AP2B1)! Non sembra invece legarsi direttamente alla clatrina o alle altre subunità di AP-2 (α-adaptina 1 e 2). Questa interazione con la β-adaptina è fondamentale perché è proprio questa subunità che, in genere, lega la clatrina. Abbiamo anche osservato che RAB23, β-adaptina e clatrina si trovano spesso insieme, nello stesso punto, vicino alla membrana cellulare, suggerendo che collaborino strettamente durante la formazione della vescicola.
Ma non finisce qui! La formazione di una vescicola richiede diverse fasi:
- Assemblaggio del rivestimento: Oltre ad AP-2, serve una proteina chiamata PICALM per aiutare la clatrina ad assemblarsi correttamente.
- Curvatura della membrana: La membrana deve piegarsi per formare la bolla. Qui entra in gioco una proteina come l’endofilina A2.
- Distacco (scissione): La vescicola deve staccarsi dalla membrana. Una proteina coinvolta in questa fase è la cortactina.
Ebbene, abbiamo scoperto che RAB23 interagisce con tutte e tre queste proteine: PICALM, endofilina A2 e cortactina! Questo è un risultato pazzesco, perché suggerisce che RAB23 non agisca solo in un punto, ma possa facilitare molteplici passaggi nella creazione della vescicola rivestita di clatrina, dalla selezione del carico fino al distacco finale.
La prova del nove: cosa succede quando manca RAB23?
Ok, RAB23 interagisce con tutti questi attori chiave. Ma cosa succede concretamente se RAB23 non c’è o non funziona bene? Per rispondere, abbiamo usato un modello classico: l’internalizzazione della transferrina. La transferrina è una proteina che trasporta il ferro e entra nelle cellule proprio tramite l’endocitosi clatrina-dipendente, e sappiamo che ha bisogno di PICALM (uno dei partner di RAB23) per entrare.
Abbiamo confrontato cellule normali (WT, Wild Type) con cellule prive di RAB23 (Rab23-/-) derivate da modelli murini che mimano la Sindrome di Carpenter. Utilizzando la microscopia time-lapse (filmando le cellule in tempo reale), abbiamo osservato cosa succedeva quando aggiungevamo transferrina marcata in rosso:
- Nelle cellule normali (WT), la transferrina veniva internalizzata rapidamente ed efficientemente dalla membrana.
- Nelle cellule senza RAB23 (Rab23-/-), il processo era molto più lento e inefficiente. La transferrina rimaneva “bloccata” sulla superficie cellulare per più tempo, e a volte, anche dopo essere entrata, veniva “respinta” fuori!
Abbiamo confermato questi risultati misurando la quantità di transferrina internalizzata con altre tecniche (Western Blotting e Citofluorimetria): le cellule senza RAB23 ne internalizzavano significativamente meno a tutti i tempi analizzati. Inoltre, abbiamo visto che nelle cellule Rab23-/-, la transferrina passava più tempo associata ad AP-2 sulla membrana, come se il processo di “carico e partenza” fosse inceppato.
Per essere sicuri che fosse proprio la mancanza di RAB23 la causa, abbiamo fatto un esperimento di “salvataggio”: abbiamo preso cellule umane (MG-63) in cui avevamo artificialmente ridotto i livelli di RAB23 (usando siRNA) e abbiamo visto che, come previsto, internalizzavano meno transferrina. Poi, in queste stesse cellule, abbiamo re-introdotto RAB23 funzionante. Risultato? L’internalizzazione della transferrina è tornata quasi alla normalità! Questa è una prova forte che RAB23 è davvero necessario per un’efficiente endocitosi clatrina-dipendente.

L’impatto sulla comunicazione cellulare: il caso del segnale BMP
Se RAB23 è così importante per far entrare le cose nella cellula, è logico pensare che influenzi anche la segnalazione cellulare, che spesso dipende dall’internalizzazione di recettori attivati da segnali esterni (ligandi). Abbiamo studiato la via di segnalazione di BMP2 (Bone Morphogenetic Protein 2), un segnale cruciale per lo sviluppo osseo (un processo alterato nella Sindrome di Carpenter) e che sappiamo utilizzare la via della clatrina per entrare e attivare la segnalazione interna (tramite la fosforilazione di proteine chiamate SMAD).
Cosa abbiamo osservato?
- Quando stimolavamo le cellule con BMP2, le cellule normali (WT) formavano rapidamente vescicole contenenti clatrina e AP-2 vicino alla membrana.
- Nelle cellule senza RAB23 (Rab23-/-), la formazione di queste vescicole era aberrante, meno efficiente e le strutture formate sembravano disorganizzate.
- Crucialmente, abbiamo scoperto che nelle cellule Rab23-/-, l’interazione fisica tra la β-adaptina (AP-2) e la clatrina era significativamente ridotta. Sembra quindi che RAB23 sia necessario per “cementare” l’unione tra AP-2 e clatrina durante la formazione della vescicola.
- Come conseguenza di questa difettosa formazione di vescicole, la segnalazione di BMP2 era compromessa: le cellule Rab23-/- mostravano livelli più bassi di pSMAD1/5/8 (il segnale attivato da BMP2) rispetto alle cellule normali.
Questo dimostra un legame diretto tra il ruolo meccanico di RAB23 nella formazione delle vescicole e la sua capacità di modulare la comunicazione cellulare.
Uno sguardo al quadro generale: l’analisi genica
Per avere una visione d’insieme, abbiamo rianalizzato dati di espressione genica (microarray) che avevamo ottenuto in passato confrontando cellule WT e Rab23-/-. Utilizzando strumenti bioinformatici, abbiamo cercato quali “percorsi” o “funzioni” biologiche fossero più influenzate dalla mancanza di RAB23. I risultati hanno confermato magnificamente le nostre scoperte sperimentali! Molti dei geni espressi differentemente erano coinvolti proprio in:
- Trasporto mediato da vescicole
- Trasporto di membrana
- Endocitosi
- Regolazione del citoscheletro di actina (importante per la forma e il movimento cellulare, inclusa la formazione di vescicole)
- Via di segnalazione del recettore TGF-beta (di cui BMP fa parte)
- Attività di trasduzione del segnale e recettori accoppiati a proteine G
Conclusioni: RAB23, un facilitatore multifunzionale
Mettendo insieme tutti i pezzi, emerge un quadro affascinante: RAB23 agisce come un facilitatore cruciale in molteplici fasi della formazione delle vescicole rivestite di clatrina alla membrana plasmatica. Non è solo un semplice interruttore, ma sembra coordinare diversi attori chiave (AP-2/β-adaptina, PICALM, endofilina A2, cortactina) per garantire che il processo di internalizzazione del carico avvenga in modo efficiente.
La sua interazione con la β-adaptina di AP-2 e la sua influenza sull’assemblaggio della clatrina sono probabilmente centrali. Quando RAB23 manca o non funziona, l’intero processo rallenta, diventa inefficiente, e questo ha ripercussioni dirette sulla capacità della cellula di ricevere e interpretare segnali dall’esterno, come abbiamo visto con BMP2.
Questo nuovo ruolo di RAB23 nel traffico di membrana ci aiuta a capire meglio non solo i meccanismi fondamentali della biologia cellulare, ma anche come le alterazioni di questo processo possano portare a malattie dello sviluppo come la Sindrome di Carpenter e potenzialmente influenzare altre condizioni, inclusi i tumori, dove RAB23 è spesso deregolato.
Insomma, la prossima volta che pensate a come comunicano le vostre cellule, ricordatevi di questo piccolo ma potente regista, RAB23, che lavora instancabilmente dietro le quinte per assicurarsi che il traffico scorra liscio e i messaggi giusti arrivino a destinazione!
Fonte: Springer