Endometriosi: Ho Trovato la Chiave? Come la Proteina PYK2 Accende la Malattia!
Ciao a tutti! Oggi voglio parlarvi di una scoperta che mi ha davvero appassionato e che potrebbe aprire nuove strade per combattere una malattia tanto diffusa quanto complessa: l’endometriosi. Sapete, quella condizione che colpisce milioni di donne in età fertile, causando dolore cronico, problemi di fertilità e un impatto pesante sulla qualità della vita. È un vero rompicapo per la medicina, perché le sue cause esatte sono ancora avvolte nel mistero e le terapie attuali, purtroppo, non sono sempre risolutive.
Mentre mi addentravo nei meccanismi molecolari di questa patologia, mi sono imbattuto in una proteina dal nome un po’ tecnico, PYK2 (Proline-rich Tyrosine Kinase 2), e ho iniziato a sospettare che potesse giocare un ruolo da protagonista in questa storia. Ebbene, le mie ricerche, insieme a quelle del team con cui ho collaborato, sembrano confermare questi sospetti!
Cos’è l’Endometriosi e Perché è un Problema Serio?
Prima di tuffarci nei dettagli molecolari, facciamo un passo indietro. L’endometriosi si verifica quando tessuto simile a quello che riveste internamente l’utero (l’endometrio) cresce al di fuori di esso, ad esempio sulle ovaie, sulle tube, sull’intestino o sulla vescica. Questo tessuto “fuori posto” si comporta come quello uterino: risponde agli ormoni del ciclo mestruale, cresce, si sfalda e sanguina. Ma, a differenza del flusso mestruale che viene espulso, questo sangue e tessuto rimangono intrappolati nel corpo, causando infiammazione cronica, dolore (spesso invalidante, specialmente durante il ciclo o i rapporti), aderenze e, in molti casi, infertilità.
Pensate che fino al 50% delle donne infertili soffre di endometriosi! Le cause dell’infertilità sono diverse: dalle aderenze che “bloccano” le tube, alle alterazioni ormonali e immunitarie, fino a una ridotta capacità dell’endometrio (quello giusto, nell’utero) di accogliere l’embrione (la cosiddetta “ricettività endometriale”) e una diminuzione della riserva ovarica. La diagnosi è spesso tardiva (si parla di anni!) e le cure attuali, come la chirurgia o le terapie ormonali, hanno i loro limiti: la chirurgia può portare a dolore post-operatorio o recidive, mentre gli ormoni bloccano i sintomi ma non curano la malattia alla radice e non risolvono l’infertilità. Ecco perché è fondamentale capire cosa succede a livello cellulare.
Il Sospettato Principale: La Proteina PYK2
Torniamo alla nostra proteina, la PYK2. È una “tirosin-chinasi non recettoriale”, il che significa che è un enzima specializzato nell’aggiungere gruppi fosfato ad altre proteine (un processo chiamato fosforilazione), modificandone l’attività e regolando così vie di segnalazione cruciali all’interno della cellula. La PYK2 è nota per influenzare la proliferazione (la crescita e divisione delle cellule), la sopravvivenza e la migrazione cellulare. Spesso è coinvolta nella progressione dei tumori, ma il suo ruolo nell’endometriosi era finora sconosciuto.
La prima cosa che abbiamo fatto è stata controllare i livelli di PYK2 nei tessuti. Abbiamo analizzato campioni prelevati da pazienti con endometriosi confermata (lesioni ectopiche, cioè fuori posto) e li abbiamo confrontati con tessuto endometriale normale (sia da donne sane che dalla stessa paziente ma prelevato dall’utero, detto “eutopico”). I risultati sono stati chiari: la PYK2 era significativamente più abbondante nelle lesioni endometriosiche! Questo è stato il primo campanello d’allarme.
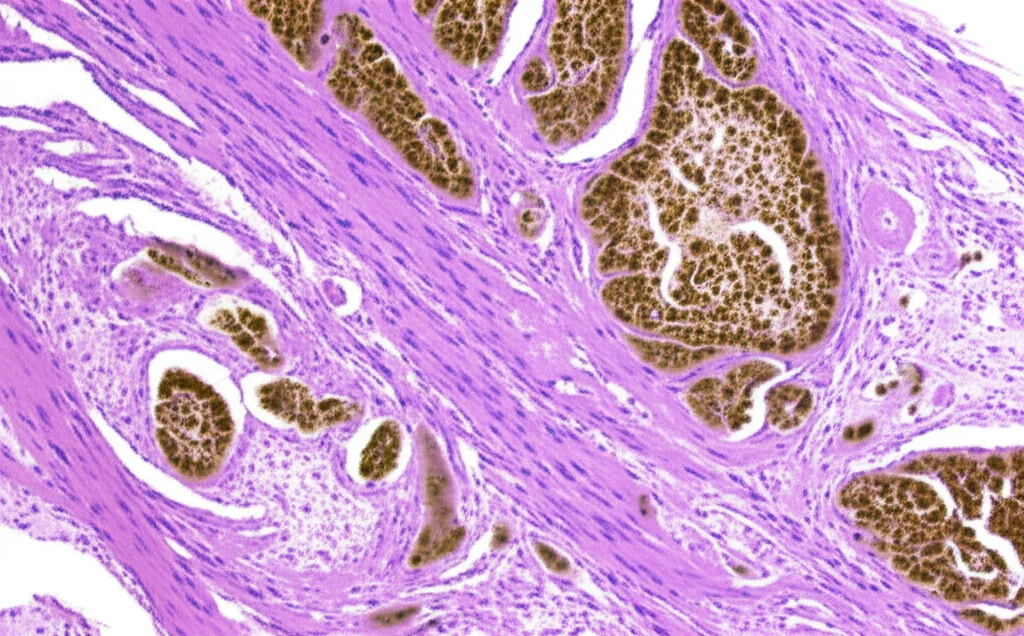
PYK2: Il Motore della Crescita e dell’Invasione
Avere tanta PYK2 nelle lesioni suggeriva che potesse essere lei a “spingere” le cellule endometriosiche a comportarsi in modo anomalo. Per verificarlo, abbiamo condotto esperimenti in vitro usando cellule stromali endometriali (HESC da endometrio normale, EESC da lesioni ectopiche) e una linea cellulare specifica (11Z).
Cosa abbiamo scoperto? Quando aumentavamo artificialmente i livelli di PYK2 in queste cellule, queste iniziavano a:
- Proliferare più velocemente (si moltiplicavano di più).
- Migrare più attivamente (si spostavano di più).
- Invadere con maggiore aggressività (riuscivano a superare barriere artificiali che mimano i tessuti).
Al contrario, quando riducevamo i livelli di PYK2 (usando tecniche di “silenziamento genico”), tutti questi comportamenti “aggressivi” diminuivano. Insomma, la PYK2 sembrava proprio dare alle cellule endometriosiche quella spinta in più per crescere, muoversi e infiltrarsi nei tessuti circostanti, caratteristiche tipiche dell’endometriosi (e, per certi versi, simili a quelle tumorali, anche se l’endometriosi è benigna).
Un Complice Chiave: Snail1 e la Transizione Epitelio-Mesenchimale (EMT)
Ma come fa la PYK2 a fare tutto questo? Qui entra in gioco un altro personaggio importante: la Transizione Epitelio-Mesenchimale (EMT). È un processo biologico complesso durante il quale le cellule epiteliali (che normalmente sono ben adese tra loro e formano strati ordinati) perdono la loro polarità e le loro connessioni, acquisendo caratteristiche tipiche delle cellule mesenchimali, come una maggiore capacità di muoversi e invadere. L’EMT è fondamentale durante lo sviluppo embrionale, ma è anche coinvolta in processi patologici come la fibrosi, l’infiammazione cronica e, appunto, la progressione tumorale e l’endometriosi.
Uno dei registi principali dell’EMT è un fattore di trascrizione chiamato Snail1. È noto che Snail1 è spesso iperespresso nelle lesioni endometriosiche e gioca un ruolo cruciale nel promuovere l’invasività delle cellule. Studiando le cellule in cui avevamo aumentato PYK2, abbiamo notato che anche i marcatori tipici dell’EMT cambiavano: diminuiva l’espressione di E-caderina (una proteina che tiene unite le cellule) e aumentava quella di Vimentina (tipica delle cellule mesenchimali mobili). Questo ci ha fatto pensare: e se PYK2 e Snail1 lavorassero insieme?
Il Legame Pericoloso: PYK2 Fosforila e Stabilizza Snail1
La nostra ipotesi era che PYK2 potesse influenzare direttamente Snail1. E avevamo ragione! Attraverso esperimenti di co-immunoprecipitazione (una tecnica che permette di “pescare” una proteina e vedere quali altre le sono legate), abbiamo dimostrato che PYK2 e Snail1 interagiscono fisicamente, si legano l’una all’altra all’interno della cellula, sia nel citoplasma che nel nucleo.
Ma il bello doveva ancora venire. Essendo PYK2 una chinasi, ci siamo chiesti se potesse fosforilare Snail1. Abbiamo identificato un sito specifico su Snail1 (un amminoacido chiamato tirosina in posizione 163, Y163) come potenziale bersaglio della fosforilazione da parte di PYK2. E bingo! Esperimenti successivi hanno confermato che PYK2 aggiunge un gruppo fosfato proprio in quel punto (Y163) di Snail1.
Perché è importante? Perché questa fosforilazione ha un effetto cruciale: rende la proteina Snail1 più stabile. Normalmente, le proteine come Snail1 vengono prodotte e poi degradate dalla cellula quando non servono più. La fosforilazione da parte di PYK2, invece, protegge Snail1 dalla degradazione (in particolare, riduce la sua “ubiquitinazione”, il segnale che la marca per essere distrutta). Il risultato? Più Snail1 stabile e attivo nella cellula, che a sua volta potenzia l’EMT, la migrazione e l’invasione. Abbiamo anche visto che mutando Snail1 proprio nel sito Y163, impedendo la fosforilazione, si riducevano la proliferazione e l’invasività delle cellule endometriosiche.
Un Duro Colpo alla Fertilità: PYK2 Ostacola la Decidualizzazione
C’è un altro aspetto importante legato all’infertilità nell’endometriosi. Per una gravidanza di successo, l’endometrio uterino deve subire un processo chiamato decidualizzazione, trasformandosi per poter accogliere e nutrire l’embrione. Si sa che nelle donne con endometriosi, questo processo è spesso alterato, rendendo più difficile l’impianto.
Abbiamo voluto vedere se PYK2 avesse un ruolo anche qui. Abbiamo indotto la decidualizzazione in vitro in cellule stromali endometriali normali (HESC) e abbiamo osservato cosa succedeva quando PYK2 era iperespressa. I risultati? L’eccesso di PYK2 ostacolava significativamente la decidualizzazione, come dimostrato sia dai cambiamenti morfologici delle cellule sia dalla ridotta espressione di marcatori chiave di questo processo (come PRL e IGFBP1). Questo aggiunge un altro tassello al puzzle, spiegando come PYK2 possa contribuire all’infertilità associata all’endometriosi, non solo promuovendo le lesioni ma anche rendendo l’utero meno “accogliente”.
Una Speranza Terapeutica: L’Inibitore VS-6063
Se PYK2 è così centrale nel promuovere l’endometriosi, bloccarla potrebbe essere una strategia terapeutica? Per scoprirlo, abbiamo testato un farmaco chiamato VS-6063 (Defactinib). È un inibitore che blocca l’attività sia di PYK2 che di un’altra chinasi simile, FAK (anch’essa implicata nell’endometriosi).
I risultati sono stati molto incoraggianti:
- In vitro: Trattare le cellule endometriosiche (11Z e EESC) con VS-6063 ne ha ridotto significativamente la proliferazione, la migrazione e l’invasione. Ha anche ridotto i segni dell’EMT e, cosa interessante, ha promosso la decidualizzazione nelle cellule HESC.
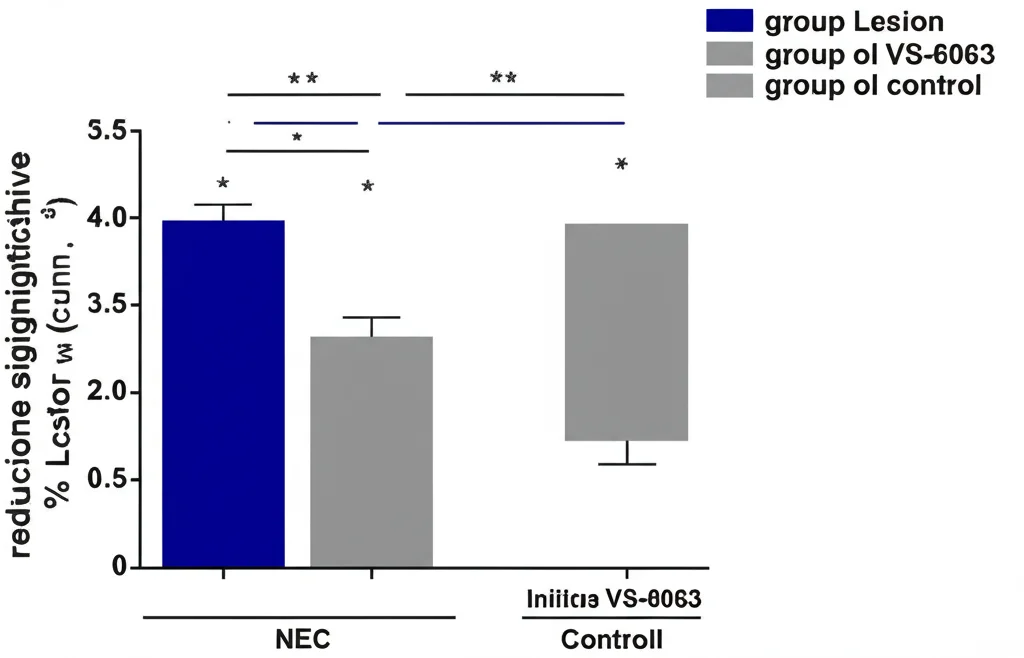
- In vivo: Abbiamo creato un modello di endometriosi nei topi e li abbiamo trattati con VS-6063. Ebbene, il farmaco ha inibito la crescita delle lesioni endometriosiche rispetto ai topi non trattati. Analizzando le lesioni dei topi trattati, abbiamo visto livelli più bassi di PYK2 e Snail1 e meno segni di proliferazione ed EMT.
Questi dati suggeriscono che colpire PYK2 (e FAK) con inibitori come VS-6063 potrebbe rappresentare una nuova e promettente opzione terapeutica per l’endometriosi, potenzialmente in grado di rallentare la progressione della malattia e forse anche di migliorare la fertilità.
Cosa Significa Tutto Questo?
In sintesi, il nostro studio ha identificato PYK2 come un nuovo attore chiave nello sviluppo e nella progressione dell’endometriosi. Abbiamo svelato un meccanismo specifico attraverso cui agisce: legandosi a Snail1, fosforilandolo nel sito Y163, stabilizzandolo e potenziando così l’EMT, la proliferazione e l’invasività delle cellule endometriosiche. Inoltre, abbiamo visto che PYK2 ostacola la decidualizzazione, contribuendo all’infertilità.
La scoperta più entusiasmante è che bloccare PYK2 con un inibitore come VS-6063 sembra essere efficace nel contrastare la malattia, almeno nei modelli preclinici. Questo apre la porta a future ricerche per sviluppare terapie mirate contro PYK2, offrendo una nuova speranza a milioni di donne che convivono con l’endometriosi. Certo, la strada è ancora lunga e serviranno ulteriori studi per confermare questi risultati nell’uomo e valutare sicurezza ed efficacia clinica, ma aver identificato un nuovo bersaglio molecolare è un passo avanti fondamentale!
Spero che questo viaggio nel mondo molecolare dell’endometriosi vi abbia interessato. È affascinante vedere come la comprensione dei meccanismi più intimi delle cellule possa portare a nuove strategie per combattere malattie complesse. Continueremo a indagare, con la speranza di trasformare queste scoperte in cure concrete.
Fonte: Springer