PRPS2: Non Solo un Enzima, Ma un Regista Inaspettato nel Cancro Polmonare!
Ciao a tutti! Oggi voglio parlarvi di una scoperta che mi ha davvero affascinato nel campo della ricerca sul cancro, in particolare sull’adenocarcinoma polmonare. Immaginate le cellule tumorali come delle fabbriche super efficienti, ma che lavorano per uno scopo nefasto: crescere e diffondersi. Per farlo, modificano profondamente il loro metabolismo, cioè il modo in cui producono energia e mattoncini per costruire nuove cellule. Una delle cose che fanno è “giocare” con l’epigenetica, in particolare con una modifica chimica sull’RNA chiamata m6A (N6-metiladenosina).
Questa metilazione dell’RNA è come mettere delle etichette su specifiche molecole di RNA, influenzando come vengono lette, processate e tradotte in proteine. Nel cancro, spesso vediamo un eccesso di queste etichette m6A (ipermetilazione), che sembra spingere le cellule a proliferare e a diventare metastatiche.
Il Donatore Universale di Metili: SAM
Ma come fanno le cellule a mettere queste etichette? Hanno bisogno di un “donatore” del gruppo chimico necessario (il gruppo metile -CH3). Questo donatore universale nelle nostre cellule si chiama S-adenosilmetionina, o più semplicemente SAM. Pensate al SAM come a una moneta energetica specifica per le reazioni di metilazione. Più SAM c’è, più metilazione può avvenire.
Nei tumori, specialmente in quello polmonare, i livelli di SAM sono spesso molto alti, proprio per sostenere questa ipermetilazione dell’RNA. Ma come fanno le cellule tumorali a produrre tutto questo SAM extra? Ecco il mistero che abbiamo cercato di svelare.
Entra in Scena PRPS2: Un Attore Inatteso
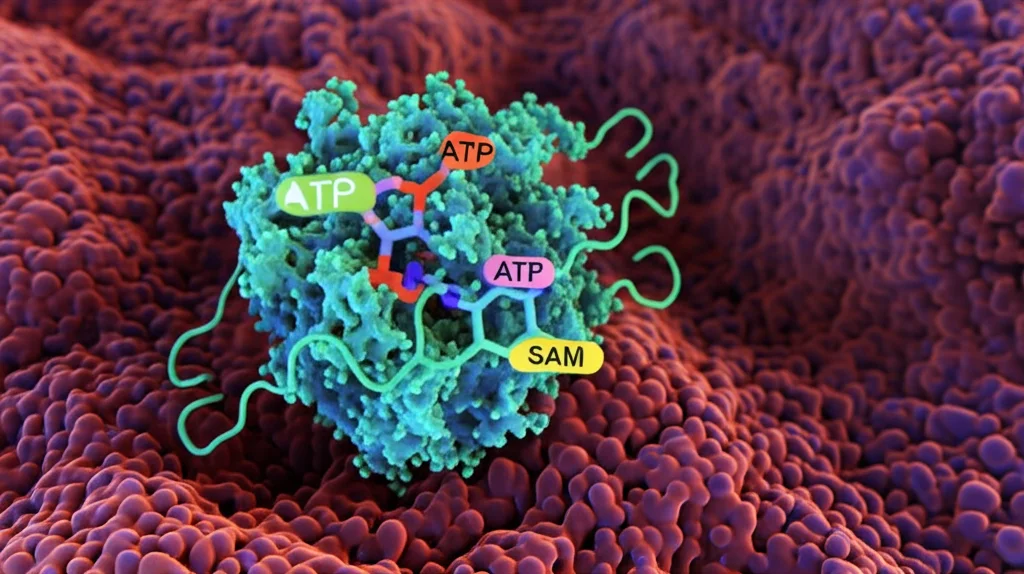
La nostra attenzione si è concentrata su un enzima chiamato PRPS2 (Fosforibosil Pirofosfato Sintetasi 2). Questo enzima fa parte della via di biosintesi delle purine, un percorso metabolico fondamentale che produce i mattoncini (nucleotidi) per costruire DNA e RNA, tra cui l’ATP, la principale moneta energetica della cellula. PRPS2 ha un “fratello” molto simile, PRPS1, con cui condivide quasi tutta la sequenza (circa il 94% di identità). Nelle cellule normali, sembrano quasi intercambiabili.
Ma nel cancro, qualcosa cambia. Abbiamo analizzato campioni di adenocarcinoma polmonare e tessuti sani adiacenti prelevati da pazienti. E indovinate un po’? Abbiamo scoperto che i livelli di PRPS2 (sia mRNA che proteina) erano significativamente più alti nei tessuti tumorali rispetto a quelli normali nella stragrande maggioranza dei casi (circa l’81%). Per PRPS1, invece, nessuna differenza significativa. Non solo, analizzando grandi database di pazienti (TCGA e GEO), abbiamo visto che alti livelli di PRPS2 sono associati a una prognosi peggiore, non solo nel cancro al polmone ma anche in altri tumori come quello al seno, al pancreas e al cervello. Chiaramente, PRPS2 stava facendo qualcosa di speciale nelle cellule tumorali, qualcosa che PRPS1 non faceva.

PRPS2 Mette il Turbo alla Crescita Tumorale
Per confermare queste osservazioni cliniche, siamo passati al laboratorio. Abbiamo preso linee cellulari di cancro al polmone con bassi livelli naturali di PRPS2 e le abbiamo modificate per fargliene produrre di più (sovraespressione). Abbiamo fatto lo stesso con PRPS1 come controllo. I risultati sono stati netti: le cellule con più PRPS2 crescevano molto più velocemente, formavano più colonie (un segno di aggressività), crescevano in modo disorganizzato (simulando un tumore solido), invadevano meglio la matrice extracellulare e migravano di più. PRPS1 promuoveva un po’ la crescita, ma niente a che vedere con l’effetto “turbo” di PRPS2. Addirittura, PRPS2 riusciva a far proliferare e trasformare cellule polmonari normali (fibroblasti), cosa che PRPS1 non faceva. Era chiaro: PRPS2 ha un ruolo oncogenico ben distinto.
Meccanismo 1: PRPS2 Ignora i Segnali di Stop (Funzione Enzimatica)
Ma perché questa differenza? Entrambi gli enzimi catalizzano la stessa reazione: prendono il Ribosio-5-fosfato (R5P, derivato dal glucosio) e l’ATP per produrre PRPP, un intermedio chiave per fare nuove purine (come l’ATP stesso). Abbiamo usato una tecnica sofisticata (tracciamento isotopico con 13C-glucosio) per seguire il flusso dei metaboliti lungo questa via. Nelle cellule che sovraesprimevano PRPS2, abbiamo visto un consumo più rapido di R5P e una produzione maggiore di PRPP e di tutti i prodotti a valle, inclusi ATP e GTP. Quindi, PRPS2 stava effettivamente accelerando la produzione di purine.
Qui arriva il bello. Normalmente, l’attività degli enzimi PRPS è strettamente regolata. Quando i prodotti finali della via (come ADP o GDP) si accumulano, si legano all’enzima in un sito diverso da quello attivo (sito allosterico) e lo “spengono”. È un meccanismo di feedback negativo, essenziale per evitare sprechi. Abbiamo testato questa regolazione in provetta. PRPS1 veniva inibito dal GDP, come previsto. Ma PRPS2? Era praticamente insensibile! Potevamo aggiungere alte concentrazioni di GDP, ma lui continuava a lavorare imperterrito.
Come è possibile? Studiando la struttura tridimensionale delle proteine ai raggi X (cristallografia), abbiamo scoperto la chiave. PRPS2 ha tre amminoacidi in più (Valina-Glicina-Glutammina, che abbiamo chiamato 3AA) in una regione cruciale (Loop2) rispetto a PRPS1. Questi 3AA, insieme a un’altra piccola differenza (una Glutammina al posto di una Lisina in posizione 156/153), cambiano la forma dell’enzima proprio vicino al sito di legame del GDP, impedendogli fisicamente di legarsi e di esercitare l’inibizione. In pratica, PRPS2 ha “modificato” il suo interruttore di spegnimento!

Abbiamo confermato questa ipotesi creando delle versioni “chimeriche”: abbiamo inserito i 3AA e la mutazione Q156K in PRPS1 e, viceversa, abbiamo tolto i 3AA e messo la K153Q in PRPS2. I risultati? Le funzioni si sono invertite! Il PRPS1 modificato è diventato insensibile al feedback e ha promosso la crescita tumorale come PRPS2, mentre il PRPS2 modificato è diventato sensibile e ha perso gran parte della sua capacità oncogenica. Questo dimostra che la capacità di PRPS2 di bypassare l’inibizione da feedback è fondamentale per il suo ruolo nel cancro, permettendogli di produrre continuamente un eccesso di ATP.
Meccanismo 2: PRPS2 Stringe un’Alleanza Strategica (Funzione Non Enzimatica)
Ma c’era dell’altro. Quando abbiamo provato a “spegnere” PRPS2 (knockdown con shRNA) nelle cellule tumorali che ne avevano alti livelli, la crescita cellulare si bloccava drasticamente. Spegnere PRPS1, invece, aveva effetti minimi. Questo suggeriva che PRPS2 facesse anche qualcos’altro, oltre alla sua funzione enzimatica.
Abbiamo quindi cercato proteine con cui PRPS2 potesse interagire fisicamente. Usando una tecnica di “pesca” molecolare (pulldown con tag Flag), abbiamo identificato alcuni partner specifici di PRPS2. Tra questi, uno ha catturato la nostra attenzione: MAT2A (Metionina Adenosiltransferasi 2A). Perché è interessante? Perché MAT2A è l’enzima che produce il famoso SAM, usando come ingredienti la metionina e… l’ATP! Proprio l’ATP che PRPS2 produce in eccesso.
Con esperimenti di co-immunoprecipitazione (Co-IP), abbiamo confermato che PRPS2 e MAT2A si legano direttamente dentro le cellule. E non è tutto. Abbiamo scoperto che legandosi a MAT2A, PRPS2 lo rende più stabile, ne aumenta la “vita media” all’interno della cellula (lo abbiamo visto con esperimenti di stabilità termica, CETSA, e inseguimento con cicloesimide, CHX). PRPS1, invece, non interagisce con MAT2A e non ne influenza la stabilità.
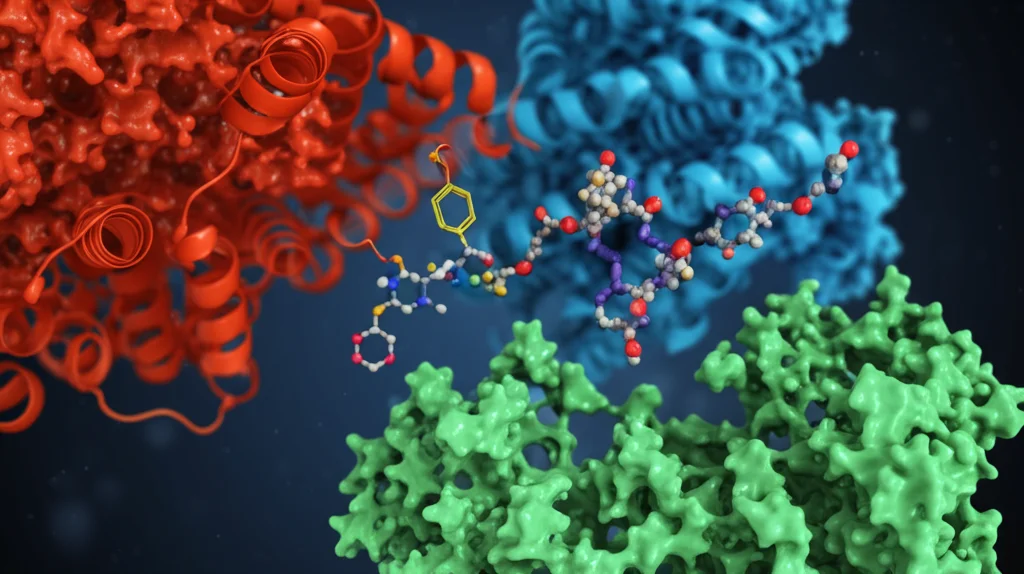
L’Asse PRPS2-MAT2A: Una Fabbrica di SAM per la Metilazione dell’RNA
Ecco che il quadro si completa. PRPS2 fa due cose fondamentali nel cancro:
- Funzione enzimatica: Bypassa l’inibizione da feedback e produce continuamente un eccesso di ATP.
- Funzione non enzimatica (o “scaffolding”): Interagisce con MAT2A, lo stabilizza e lo rende più efficiente nell’usare l’eccesso di ATP (e metionina) per produrre grandi quantità di SAM.
Abbiamo verificato questo flusso metabolico usando ancora il tracciamento isotopico (sia con 13C-glucosio che con 13C-metionina). Nelle cellule con più PRPS2, abbiamo visto un rapido consumo di ATP e metionina e un accumulo significativo di SAM e del suo prodotto “usato”, SAH (S-adenosilomocisteina).
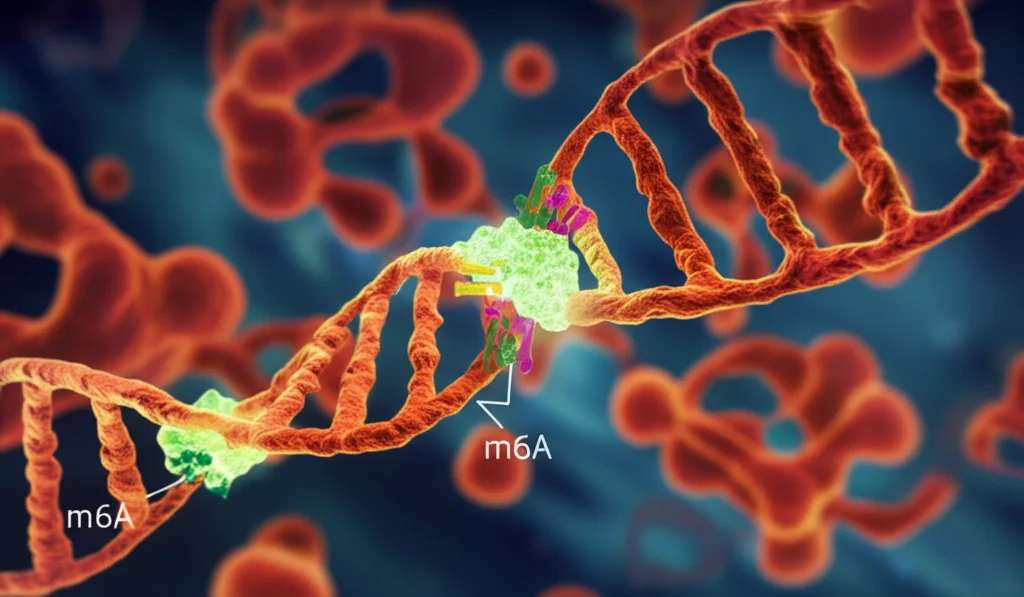
E dove va a finire tutto questo SAM extra? Abbiamo misurato vari tipi di metilazione epigenetica (su DNA, RNA, istoni). Il risultato è stato sorprendente: l’eccesso di SAM prodotto grazie all’asse PRPS2-MAT2A viene utilizzato specificamente per aumentare la metilazione m6A sull’RNA! Le altre modifiche non cambiavano significativamente.
Infine, abbiamo identificato chi materialmente appone queste etichette m6A: il complesso enzimatico WTAP/METTL3/METTL14. Quando abbiamo bloccato questo complesso (con siRNA o con un inibitore specifico), l’aumento di m6A indotto da PRPS2 veniva annullato.
Conclusioni e Prospettive Future
Quindi, abbiamo scoperto un meccanismo affascinante e a doppio binario con cui PRPS2 promuove il cancro polmonare. Agisce sia come enzima “ribelle” che produce ATP senza sosta, sia come “stabilizzatore” di MAT2A, creando così una super-fabbrica di SAM dedicata a ipermetilare l’RNA m6A tramite il complesso WTAP/METTL3/METTL14. Questo asse metabolico-epigenetico (PRPS2-MAT2A-WTAP/METTL3/METTL14) è cruciale per la crescita e la progressione tumorale.
La cosa entusiasmante è che PRPS2 sembra essere particolarmente importante per le cellule tumorali, mentre è meno espresso nei tessuti normali. Questo lo rende un bersaglio terapeutico potenzialmente molto interessante. Immaginate di poter sviluppare farmaci che blocchino selettivamente la sua attività enzimatica (magari legandosi alla sua regione Loop2 unica) o che impediscano la sua interazione con MAT2A. Potremmo così tagliare i rifornimenti di SAM alle cellule tumorali e fermare l’ipermetilazione dell’RNA, colpendo il tumore in un suo punto debole.
Questa ricerca apre nuove strade per capire come metabolismo ed epigenetica collaborino nel cancro e, speriamo, per sviluppare terapie più mirate ed efficaci in futuro. È un campo in continua evoluzione e sono convinto che scoperte come questa ci avvicinino sempre di più a comprendere e combattere questa malattia complessa.
Fonte: Springer