Protoplasti di Vite: Spogliare le Cellule per Svelare i Segreti della Genetica!
Ciao a tutti! Oggi voglio portarvi con me in un viaggio affascinante nel cuore delle cellule vegetali, in particolare quelle della vite, una pianta tanto preziosa quanto complessa. Parleremo di protoplasti: vi suona strano? Immaginate una cellula vegetale a cui togliamo delicatamente la sua “armatura”, la parete cellulare. Quello che rimane è il protoplasto, una sorta di cellula “nuda”, racchiusa solo dalla sua membrana plasmatica. Perché ci interessano così tanto queste cellule spogliate? Beh, sono uno strumento potentissimo nel mondo delle biotecnologie!
Perché i Protoplasti Sono Così Speciali?
I protoplasti sono come una tela bianca per noi biotecnologi. Possiamo usarli per studiare come funzionano i geni, per verificare l’efficacia di nuove tecniche di genome editing (quelle forbici molecolari come CRISPR, per intenderci) e, potenzialmente, per rigenerare intere piante modificate geneticamente, magari senza inserire geni estranei in modo permanente (transgene-free). Pensate che figata: poter migliorare la vite, renderla più resistente alle malattie o agli stress climatici, in modo mirato e veloce!
Recentemente, il genome editing ha fatto passi da gigante, e l’uso dei protoplasti permette di ottenere piante modificate in modo “pulito”, senza chimere (cioè tessuti misti geneticamente) e senza geni “extra” indesiderati. Il processo, però, non è una passeggiata: isolare i protoplasti, trasformarli (cioè inserire il materiale genetico desiderato) e farli rigenerare richiede mani esperte e tanta pazienza. Soprattutto l’isolamento e la rigenerazione sono spesso i veri scogli, limitando l’uso di questa tecnica, specialmente in piante legnose come la vite.
Nella vite, in particolare, gli studi sull’uso di protoplasti isolati dalle foglie sono ancora pochi. Mancava un protocollo davvero efficiente e affidabile, soprattutto per cultivar specifiche come il famoso Chardonnay. Ogni varietà, infatti, ha le sue esigenze!
La Nostra Missione: Ottimizzare per lo Chardonnay
Ecco dove entriamo in gioco noi. Ci siamo messi all’opera per sviluppare un sistema robusto ed efficiente proprio per lo Chardonnay. L’obiettivo? Ottimizzare ogni singolo passaggio: dall’isolamento dei protoplasti dalle foglie alla loro trasformazione usando una tecnica chiamata “mediata da PEG” (polietilenglicole, una sostanza che aiuta il DNA a entrare nelle cellule).
Abbiamo sperimentato un sacco di variabili: l’età delle foglie (spoiler: quelle giovani sono le migliori!), la quantità di tessuto da usare, come tagliuzzare le foglie (un taglio delicato a striscioline si è rivelato vincente!), l’uso di pre-trattamenti (il mannitolo, che aiuta in altre piante, qui ha fatto cilecca!), il tempo di “digestione” con gli enzimi che sciolgono la parete cellulare (8 ore è il tempo perfetto!), come filtrare e separare i protoplasti buoni da scarti e cellule danneggiate.
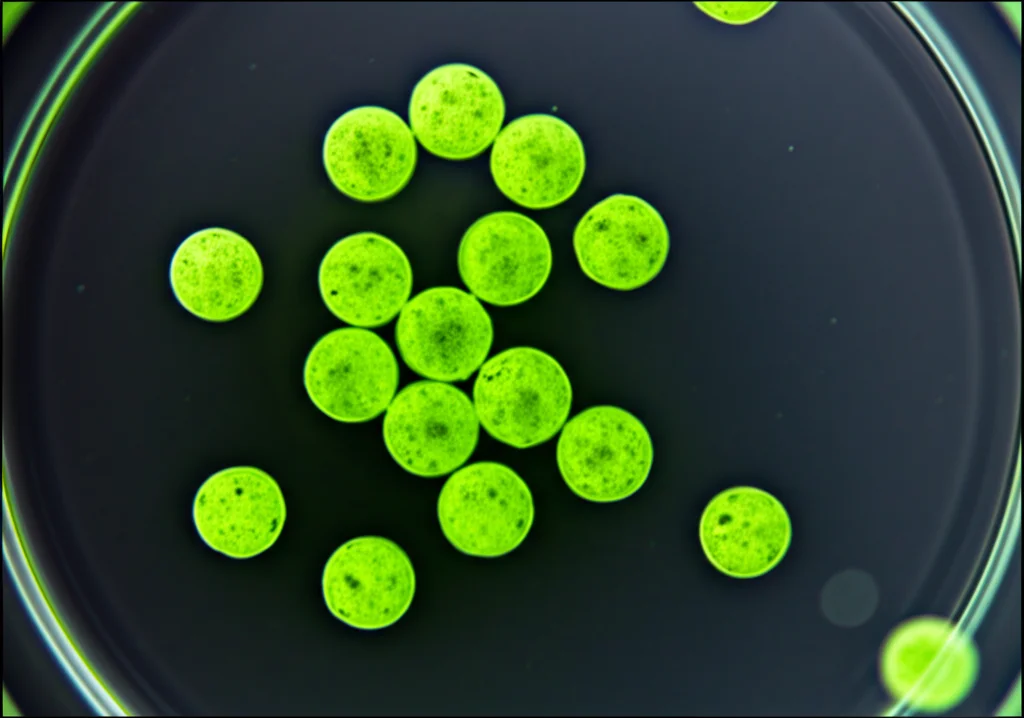
E i risultati? Siamo riusciti a ottenere circa 75 milioni di protoplasti vitali per ogni grammo di foglia, con una vitalità pazzesca del 91%! Un successone! Questi protoplasti non solo erano tanti, ma anche sani e pronti per il passo successivo.

Trasformazione: Inserire Nuove Istruzioni Genetiche
Una volta ottenuti i nostri protoplasti sani, era il momento di trasformarli. Abbiamo usato un plasmide (una molecola di DNA circolare) contenente un gene per la proteina fluorescente verde (GFP). Perché la GFP? È come un evidenziatore genetico: se la trasformazione funziona, i protoplasti si illuminano di verde sotto una luce speciale. È un modo facile e veloce per vedere se il nostro DNA è entrato!
Anche qui, abbiamo ottimizzato tutto: quanti protoplasti usare per ogni esperimento (circa mezzo milione si è rivelato l’ideale), quanto tempo lasciarli a contatto con il PEG (bastano 5 minuti, di più li danneggia!), in quale soluzione incubarli dopo la trasformazione (la soluzione W5 è stata la migliore) e per quanto tempo aspettare prima di vedere la fluorescenza (16 ore è il top).
Il risultato? Un’efficienza di trasformazione dell’87%! Significa che quasi 9 protoplasti su 10 avevano accolto il nuovo gene. Abbiamo anche confermato la presenza del gene GFP usando la PCR, una tecnica che amplifica specifiche sequenze di DNA. Vedere quelle cellule illuminarsi di verde al microscopio è stata una bella soddisfazione, ve lo assicuro!
L’Ultima Sfida: Dalla Cellula alla Pianta (o Quasi)
Ok, abbiamo isolato e trasformato i nostri protoplasti. E adesso? Il sogno sarebbe farli rigenerare in una pianta intera. Questa è la parte più difficile, specialmente partendo da cellule di foglia (mesofillo) di vite, che sono note per essere “recalcitranti”, cioè poco inclini a rigenerare.
Abbiamo provato a coltivare i protoplasti (sia trasformati che non) su diversi terreni di coltura, sia liquidi che solidi (agarizzati), aggiungendo ormoni specifici (2,4-D e BA) per stimolare la divisione cellulare e la formazione di callo (una massa di cellule indifferenziate). Abbiamo usato anche la tecnica del “feeder layer”, dove uno strato di cellule nutrici aiuta i protoplasti a crescere.
Ebbene, siamo riusciti a farli dividere e a formare dei microcalli, piccole masserelle di cellule visibili anche a occhio nudo dopo qualche mese. Questi microcalli sono poi cresciuti diventando calli veri e propri quando trasferiti in un terreno liquido. Ma… c’è un ma. Nonostante tutti i nostri sforzi, provando anche altri terreni (Lloyd’s medium) e combinazioni ormonali (BA, NAA, TDZ), questi calli non ne hanno voluto sapere di differenziarsi ulteriormente per formare radici o germogli. Niente piantina, insomma.
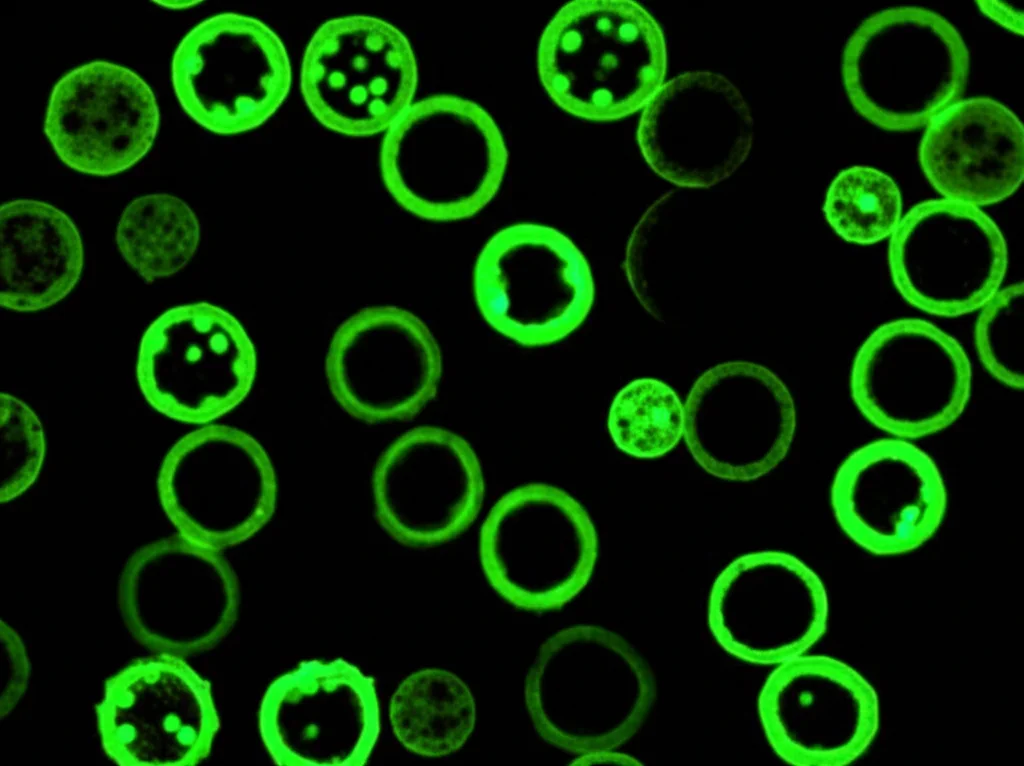
Questo risultato, anche se parzialmente deludente sul fronte della rigenerazione, conferma quanto sia ostica la vite, soprattutto partendo dalle foglie. Sembra che i protoplasti derivati da calli embriogenici (un tipo diverso di tessuto, più “giovane” e versatile) siano molto più promettenti per la rigenerazione completa, come dimostrato da altri studi. Probabilmente c’entrano fattori complessi come lo stato di metilazione del DNA (una sorta di “interruttore” epigenetico) o lo stress ossidativo.
Cosa Abbiamo Imparato e Dove Andiamo Ora?
Anche se non siamo riusciti a rigenerare la piantina completa di Chardonnay partendo dalle foglie, questo studio non è stato vano, anzi! Abbiamo messo a punto un protocollo dettagliato, affidabile ed efficiente per isolare un gran numero di protoplasti vitali dalle foglie di Chardonnay e per trasformarli geneticamente con alta efficienza. Questo è già un risultato importantissimo!
Questo sistema apre le porte a tantissime applicazioni:
- Possiamo usarlo per studiare rapidamente la funzione di geni specifici della vite.
- Possiamo testare l’efficacia di diversi costrutti per il genome editing prima di passare a trasformazioni più lunghe e complesse sull’intera pianta.
- Possiamo studiare l’interazione tra proteine o dove si localizzano all’interno della cellula.
Il nostro lavoro fornisce una solida base per futuri tentativi di ottimizzare anche la fase di rigenerazione. La sfida rimane aperta: trovare la “formula magica” di ormoni, condizioni di coltura o magari fattori genetici che possano convincere anche i protoplasti di foglia a tornare indietro nel tempo e ridiventare una pianta intera.
La strada per rivoluzionare la viticoltura tramite le biotecnologie è ancora lunga, ma ogni passo avanti, come questo, ci avvicina all’obiettivo. Non ci fermiamo qui, la ricerca continua!
Fonte: Springer