Cancro alla Prostata: La Proteomica Rivela i Segreti Nascosti tra Tumore e Stroma
Ciao a tutti! Oggi voglio parlarvi di qualcosa di veramente affascinante che sta cambiando il modo in cui guardiamo al cancro alla prostata, una delle neoplasie più comuni tra gli uomini. Sapete, per anni ci siamo basati principalmente sul punteggio di Gleason, sui livelli di PSA nel sangue e sull’analisi istologica per capire quanto fosse aggressivo un tumore e decidere la terapia. Ma se vi dicessi che c’è un mondo nascosto, a livello molecolare, che può darci informazioni ancora più precise? E se questo mondo non riguardasse solo le cellule tumorali, ma anche tutto ciò che le circonda?
Andare Oltre il Gleason: L’Importanza del Microambiente
Il sistema Gleason è fondamentale, non fraintendetemi. Ci dà una stima dell’aggressività del tumore guardando la sua architettura al microscopio. Un punteggio basso (come Gleason 6, che corrisponde al Gruppo Grado 1) indica un tumore a basso potenziale maligno, spesso gestibile con sorveglianza attiva. Un punteggio alto (come Gleason 9, Gruppo Grado 5) segnala invece un tumore molto aggressivo, con alta probabilità di progressione.
Ma il tumore non è fatto solo di cellule cancerose impazzite (l’epitelio tumorale). È immerso in un complesso ecosistema chiamato microambiente tumorale (TME), che include vasi sanguigni, cellule immunitarie e, soprattutto, lo stroma. Lo stroma è come l’impalcatura, il tessuto connettivo che supporta l’epitelio. Nella prostata sana, lo stroma è composto principalmente da cellule muscolari lisce. Ma nel cancro, questo ambiente si trasforma radicalmente: arrivano molti fibroblasti, la matrice extracellulare viene rimodellata e, spesso, il sistema immunitario sembra essere “addormentato” o addirittura complice.
Da tempo sospettiamo che lo stroma non sia un semplice spettatore, ma un attore protagonista nella progressione del cancro. Alcuni ricercatori hanno persino proposto di “dare un voto” anche allo stroma reattivo, oltre che all’epitelio tumorale! Ed è qui che entra in gioco la proteomica.
La Lente d’Ingrandimento Molecolare: Proteomica e Microdissezione Laser
Cosa succederebbe se potessimo “zoomare” a livello delle proteine, i veri operai della cellula, e vedere cosa cambia tra un tumore prostatico di basso grado (Gleason 6) e uno di alto grado (Gleason 9)? E se potessimo farlo separando nettamente le cellule tumorali (epitelio) dal loro stroma circostante?
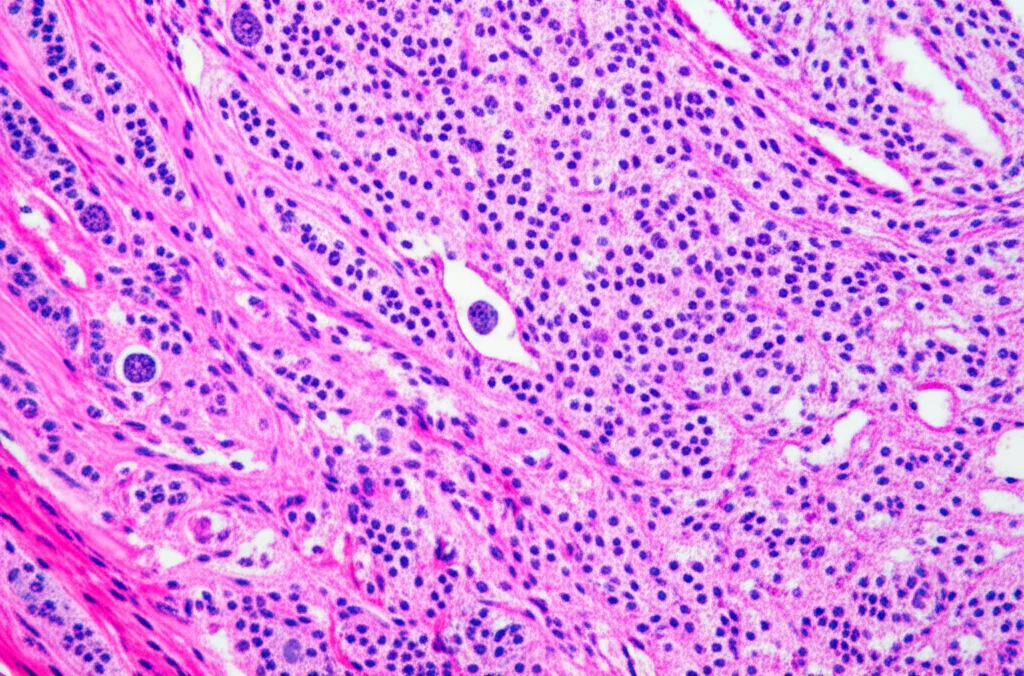
È esattamente quello che ha fatto un recente studio, utilizzando una tecnica pazzesca chiamata microdissezione laser (LMD). Immaginate un microscopio potentissimo accoppiato a un laser ultra-preciso. Con questo strumento, i ricercatori sono riusciti a “ritagliare” con cura chirurgica le aree di epitelio tumorale e le aree di stroma da campioni di tessuto prostatico (ottenuti da prostatectomie radicali) di pazienti con Gleason 6 e Gleason 9. Hanno isolato anche le controparti “benigne” (epitelio e stroma non tumorali) dagli stessi campioni, per avere un confronto.
Una volta isolate queste diverse popolazioni cellulari, è entrata in scena la spettrometria di massa tandem ad alta risoluzione accoppiata a cromatografia liquida (LC-MS/MS). Un nome complicato, lo so, ma pensatela come una bilancia incredibilmente sensibile capace di identificare e quantificare migliaia di proteine diverse in ogni minuscolo campione. È come avere la lista completa degli “ingredienti” proteici di ogni compartimento cellulare.

Risultati Sorprendenti: Lo Stroma Fa la Differenza (Soprattutto nel Grado Alto!)
E qui arrivano le scoperte più intriganti. Analizzando migliaia di proteine (oltre 8000 nell’epitelio e 6000 nello stroma!), i ricercatori hanno fatto alcune osservazioni chiave:
- Differenze legate al grado, ma solo nel tumore: Confrontando i campioni Gleason 6 con i Gleason 9, sono emerse centinaia di proteine significativamente alterate sia nell’epitelio tumorale (789 proteine) sia nello stroma associato al tumore (ben 1244 proteine!).
- Il tessuto benigno è… benigno: Sorprendentemente, l’epitelio benigno e lo stroma benigno prelevati da pazienti con tumori di grado diverso (Gleason 6 vs 9) erano praticamente identici a livello proteico. Questo ci dice che le alterazioni significative sono proprio legate al processo tumorale e alla sua aggressività, non a differenze preesistenti nel paziente.
- Lo stroma del Gleason 9 è unico: Questa è forse la scoperta più notevole. Mentre non c’erano quasi differenze proteiche tra lo stroma tumorale (ES) e quello benigno (BS) nei casi Gleason 6, nel Gleason 9 la storia cambiava completamente! Ben 1332 proteine erano significativamente alterate nello stroma tumorale del Gleason 9 rispetto al suo corrispettivo benigno. E, cosa cruciale, queste alterazioni erano esclusive del Gleason 9. È come se lo stroma, nei tumori più aggressivi, subisse una trasformazione profonda e specifica.
Vie Metaboliche Sotto i Riflettori: Colesterolo e Nucleotidi
Ma quali sono queste proteine che cambiano così tanto, soprattutto nello stroma dei tumori più aggressivi? L’analisi dei percorsi biologici (pathway analysis) ha rivelato due aree particolarmente “calde”:
1. Biosintesi del Colesterolo: Sappiamo da tempo che il metabolismo del colesterolo è spesso deregolato nel cancro alla prostata. Questo studio ha mostrato che diverse proteine coinvolte nella produzione di colesterolo erano significativamente più abbondanti nello stroma tumorale dei casi Gleason 9 rispetto allo stroma benigno. Curiosamente, nell’epitelio, la situazione era opposta: le vie del colesterolo sembravano più attive nelle cellule benigne che in quelle tumorali. Questo suggerisce che lo stroma dei tumori aggressivi potrebbe diventare una sorta di “fabbrica” di colesterolo, fornendo questo lipide essenziale alle cellule tumorali vicine per la loro crescita e proliferazione. Pensateci: le statine, farmaci che abbassano il colesterolo, sono state associate a una riduzione della mortalità e dell’aggressività del cancro alla prostata in alcuni studi. Forse agiscono proprio bloccando questa “fonte” stromale?

2. Metabolismo dei Nucleotidi: I nucleotidi sono i mattoncini fondamentali per costruire DNA e RNA, essenziali per la replicazione cellulare. Qui emerge un’altra differenza affascinante tra basso e alto grado. Nell’epitelio tumorale del Gleason 6, sembravano attive le vie di sintesi de novo dei nucleotidi (cioè la produzione da zero, un processo dispendioso energeticamente). Nell’epitelio del Gleason 9, invece, queste vie erano meno evidenti, mentre sembravano più importanti le vie di salvataggio (salvage pathways), che riciclano nucleotidi preesistenti, un processo più efficiente. E dove potrebbero trovare questi nucleotidi da riciclare le cellule tumorali del Gleason 9? Indovinate un po’? Proprio nello stroma tumorale del Gleason 9, dove le vie di sintesi de novo dei nucleotidi erano particolarmente arricchite rispetto allo stroma benigno! Sembra quasi che le cellule tumorali aggressive “esternalizzino” la produzione di mattoncini allo stroma circostante, per poi “rubarli” e riciclarli efficientemente per la propria crescita sfrenata. Questo apre scenari terapeutici interessanti: potremmo colpire non solo le cellule tumorali, ma anche le “riserve” stromali di nucleotidi?
Implicazioni e Prospettive Future
Cosa ci portiamo a casa da tutto questo? Prima di tutto, la conferma che il cancro alla prostata è una malattia complessa dove l’interazione tra cellule tumorali e microambiente è fondamentale, specialmente nelle forme più aggressive. Lo stroma non è un’impalcatura passiva, ma un vero e proprio partner (spesso in crime!) del tumore.
Questa ricerca, grazie alla potenza della proteomica risolta istologicamente (cioè che distingue epitelio e stroma), ci ha mostrato differenze molecolari nette tra tumori di basso e alto grado, differenze che risiedono esclusivamente nel microambiente tumorale. In particolare, lo stroma dei tumori Gleason 9 sembra avere un profilo proteico unico, con un’alterata capacità di produrre colesterolo e nucleotidi, risorse potenzialmente sfruttate dalle cellule tumorali per sostenere la loro aggressività.

Questi dati rafforzano l’idea che strategie terapeutiche mirate non solo all’epitelio tumorale ma anche allo stroma potrebbero essere particolarmente efficaci, soprattutto nei tumori ad alto rischio. Pensiamo a combinazioni di terapie ormonali (ADT), statine (per il colesterolo stromale) e forse farmaci che interferiscono con il metabolismo o il salvataggio dei nucleotidi (alcuni chemioterapici agiscono proprio così).
Inoltre, questo studio sottolinea l’importanza di analizzare separatamente i diversi compartimenti del tumore. Studiare il tumore “in blocco” rischia di diluire o mascherare segnali cruciali provenienti da specifiche popolazioni cellulari come lo stroma. La microdissezione laser e la proteomica ci offrono gli strumenti per farlo.
Certo, siamo ancora nel campo della ricerca, ma è incredibilmente eccitante vedere come queste tecnologie ci permettano di svelare la biologia del cancro a un livello di dettaglio impensabile fino a poco tempo fa. Ogni proteina identificata, ogni pathway alterato è un potenziale tassello in più per capire, diagnosticare meglio e, speriamo, curare più efficacemente il cancro alla prostata. Il viaggio nella complessità molecolare di questa malattia è appena iniziato!
Fonte: Springer