Ostriche Guerriere: Vi Svelo l’Incredibile Strategia Immunitaria Contro i Batteri!
Ciao a tutti, appassionati di scienza e meraviglie del mare! Oggi voglio portarvi con me in un viaggio affascinante nel mondo nascosto delle ostriche, creature che spesso consideriamo solo prelibatezze, ma che nascondono meccanismi di difesa incredibilmente sofisticati. Parleremo di una battaglia microscopica, una lotta per la sopravvivenza che si svolge continuamente nei nostri mari, e di un “eroe” molecolare che ho avuto il piacere di studiare da vicino: una proteina chiamata CgCTSL-2.
Sapete, le ostriche, come la *Crassostrea gigas* (l’ostrica del Pacifico, quella che troviamo più spesso), sono fondamentali per gli ecosistemi costieri. Sono dei veri e propri ingegneri ecologici! Purtroppo, però, sono anche vulnerabili a diverse malattie, specialmente quelle causate da batteri come il temibile Vibrio splendidus. Questo batterio Gram-negativo può causare morie di massa negli allevamenti, mettendo a rischio un’industria importante e l’equilibrio marino.
Ma le ostriche non stanno lì a subire! Hanno un sistema immunitario innato, una prima linea di difesa che, vi assicuro, è tutt’altro che semplice. E qui entra in gioco la nostra protagonista: la CgCTSL-2.
Chi è CgCTSL-2? Una Proteina Chiave nella Difesa Immunitaria
Allora, cos’è questa CgCTSL-2? Fa parte della famiglia delle catepsine L (CTSL), che sono delle proteasi, cioè enzimi che “tagliano” altre proteine. Pensatele come delle forbici molecolari molto precise. Negli animali più complessi, come noi mammiferi, le CTSL sono coinvolte in tantissimi processi, dalla digestione delle proteine “estranee” (come quelle dei patogeni) all’interno delle cellule immunitarie, fino al rimodellamento dei tessuti.
Nel nostro studio sull’ostrica *Crassostrea gigas*, abbiamo identificato questa specifica catepsina L, la CgCTSL-2. Analizzando la sua struttura, abbiamo visto che è molto simile a quelle trovate in altri animali, persino nei vertebrati, segno che è una molecola conservata dall’evoluzione, un meccanismo di difesa antico ed efficace. Ha tutte le caratteristiche tipiche: un peptide segnale (che la indirizza nel posto giusto nella cellula), un pro-peptide (una sorta di “cappuccio” di sicurezza che viene rimosso per attivarla) e il dominio enzimatico maturo con i residui amminoacidici chiave per la sua funzione di “taglio”.
La cosa interessante è che abbiamo trovato l’mRNA di CgCTSL-2 (cioè le istruzioni per costruirla) in vari tessuti dell’ostrica, ma con livelli particolarmente alti nell’epatopancreas (una specie di fegato/pancreas combinato) e negli emociti. Gli emociti sono le cellule immunitarie circolanti dell’ostrica, la loro “polizia” interna. E non è tutto: quando abbiamo simulato un’infezione iniettando il batterio Vibrio splendidus, l’espressione di CgCTSL-2 negli emociti è aumentata significativamente! Questo ci ha subito suggerito che CgCTSL-2 avesse un ruolo importante nella risposta immunitaria contro questo specifico batterio. Analizzando più a fondo, abbiamo visto che la proteina si trova principalmente nei granulociti, un tipo specifico di emocita particolarmente “aggressivo” contro i patogeni.
L’Incontro Fatale: CgCTSL-2 Riconosce Specificamente Vibrio splendidus
Ma come fa CgCTSL-2 a sapere chi attaccare? Qui la storia si fa ancora più intrigante. Abbiamo condotto esperimenti in laboratorio utilizzando una versione ricombinante della proteina (rCgCTSL-2), prodotta in batteri *E. coli*. Abbiamo scoperto che rCgCTSL-2 ha un’abilità sorprendente: riconosce e si lega specificamente al batterio Vibrio splendidus! Abbiamo provato con altri batteri, sia Gram-positivi che Gram-negativi, ma niente, il legame forte avveniva solo con il *V. splendidus*.
Questo legame, inoltre, sembra dipendere dalla presenza di ioni calcio (Ca2+). Abbiamo identificato nella struttura di CgCTSL-2 un sito di legame per il calcio (“EPA”), simile a quello trovato in altre proteine che interagiscono con zuccheri complessi, come quelli presenti sulla superficie batterica (ad esempio, il lipopolisaccaride o LPS dei Gram-negativi). Infatti, abbiamo visto che rCgCTSL-2 si lega anche all’LPS, e questo legame è potenziato dal calcio.
E non solo si lega: questo incontro “attiva” la proteina! L’attività enzimatica di rCgCTSL-2 (la sua capacità di tagliare altre proteine) aumentava notevolmente quando veniva incubata con *V. splendidus* o con LPS, specialmente in presenza di calcio. È come se CgCTSL-2 riconoscesse il nemico e, grazie al calcio, si “accendesse” per prepararsi all’azione. Abbiamo anche osservato che, nell’emolinfa (il “sangue” dell’ostrica) prelevata dalle ostriche, la CgCTSL-2 nativa si co-localizzava con i batteri *V. splendidus* marcati fluorescentemente. Era la prova visiva di questo incontro mirato.
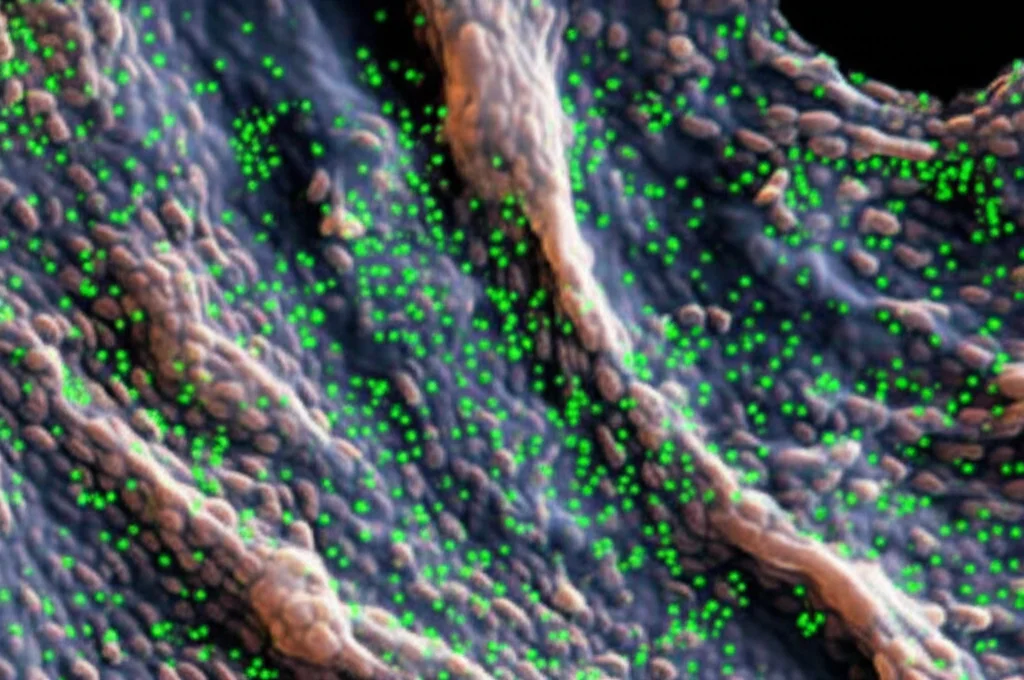
La Strategia Geniale: Attivare l’Allarme C3
A questo punto, ci siamo chiesti: cosa fa CgCTSL-2 una volta che ha “agganciato” il batterio? Degrada direttamente il batterio? I nostri test hanno mostrato che rCgCTSL-2, da sola, non sembrava in grado di uccidere o inibire significativamente la crescita di *V. splendidus*. Quindi, doveva esserci un altro meccanismo.
Qui entra in gioco un altro attore fondamentale del sistema immunitario, anche quello degli invertebrati: il sistema del complemento. Pensatelo come un sistema di allarme e “marcatura” dei pericoli. Una proteina chiave di questo sistema è la C3. Quando il sistema si attiva, la C3 viene tagliata in frammenti (come C3a e C3b). Il frammento C3b, in particolare, si attacca alla superficie del patogeno, “etichettandolo” come qualcosa da eliminare. Questo processo si chiama opsonizzazione.
Nei mammiferi, è stato visto che la catepsina L può tagliare direttamente la C3 all’interno di alcune cellule immunitarie. Poteva succedere anche nelle ostriche? La risposta è sì! Utilizzando tecniche come la co-immunoprecipitazione (che permette di vedere se due proteine interagiscono), abbiamo dimostrato che CgCTSL-2 interagisce direttamente con la proteina C3 dell’ostrica (CgC3), sia nell’emolinfa libera che all’interno degli emociti.
Ancora più importante: abbiamo visto che CgCTSL-2 è in grado di tagliare CgC3! Quando abbiamo trattato le ostriche con la proteina rCgCTSL-2 attiva, abbiamo osservato una diminuzione della CgC3 intera e un aumento dei suoi frammenti (come CgC3b e altri derivati) sia nell’emolinfa che negli emociti. Al contrario, quando abbiamo “silenziato” l’espressione di CgCTSL-2 nelle ostriche usando la tecnica dell’RNA interference (RNAi), abbiamo visto un accumulo di CgC3 intera e una riduzione di alcuni frammenti specifici nell’emolinfa, suggerendo che il taglio fosse inibito. Curiosamente, negli emociti delle ostriche “silenziate”, si accumulavano anche i frammenti di CgC3, forse perché, senza CgCTSL-2 pienamente funzionante nel passaggio successivo (la degradazione), questi frammenti non venivano processati correttamente.
Quindi, il quadro che emerge è questo: CgCTSL-2 riconosce *V. splendidus*, si attiva e, invece di attaccare direttamente il batterio, agisce sulla CgC3, tagliandola e generando i frammenti “etichetta”. Una strategia davvero elegante!
La Squadra di Pulizia: Fagocitosi e Degradazione nei Lisosomi
Una volta che il batterio *V. splendidus* è stato “etichettato” con i frammenti di CgC3, cosa succede? Entrano in azione gli emociti, le cellule spazzine. Queste cellule hanno sulla loro superficie dei recettori capaci di riconoscere i batteri opsonizzati. Uno di questi recettori, o almeno una sua componente, è probabilmente CgCD18, una proteina simile alla subunità beta degli integrine CR3 dei mammiferi, noti per legare i frammenti di C3b (in particolare iC3b).
Abbiamo osservato al microscopio che, dopo aver incubato gli emociti con *V. splendidus* marcato, sia CgC3 che CgCD18 si co-localizzavano con i batteri sulla superficie o all’interno degli emociti. Questo suggerisce che l’asse Patogeno-CgC3-CgCD18 sia funzionante anche nelle ostriche. Questo legame innesca la fagocitosi: l’emocita “inghiotte” il batterio marcato, racchiudendolo in una vescicola chiamata fagosoma.
E poi? Il fagosoma viaggia all’interno della cellula e si fonde con i lisosomi. I lisosomi sono gli “inceneritori” della cellula, organelli pieni di enzimi digestivi potentissimi, capaci di degradare quasi tutto, compresi i batteri. E indovinate chi troviamo proprio lì, nei lisosomi, insieme alla CgC3? Esatto, la nostra CgCTSL-2!
Le nostre osservazioni di co-localizzazione hanno mostrato chiaramente che CgCTSL-2 si trova nei lisosomi e che, dopo l’infezione con *V. splendidus*, sia CgCTSL-2 che i lisosomi si trovano insieme ai batteri fagocitati all’interno degli emociti. Questo suggerisce fortemente che CgCTSL-2 non solo inizia il processo attivando CgC3, ma partecipa anche alla fase finale, la degradazione del batterio all’interno del lisosoma, sfruttando la sua potente attività proteolitica in quell’ambiente acido. L’accumulo di frammenti di C3 negli emociti delle ostriche con CgCTSL-2 silenziata rafforza l’idea che questa proteina sia cruciale anche per il processamento finale all’interno del percorso lisosomiale.
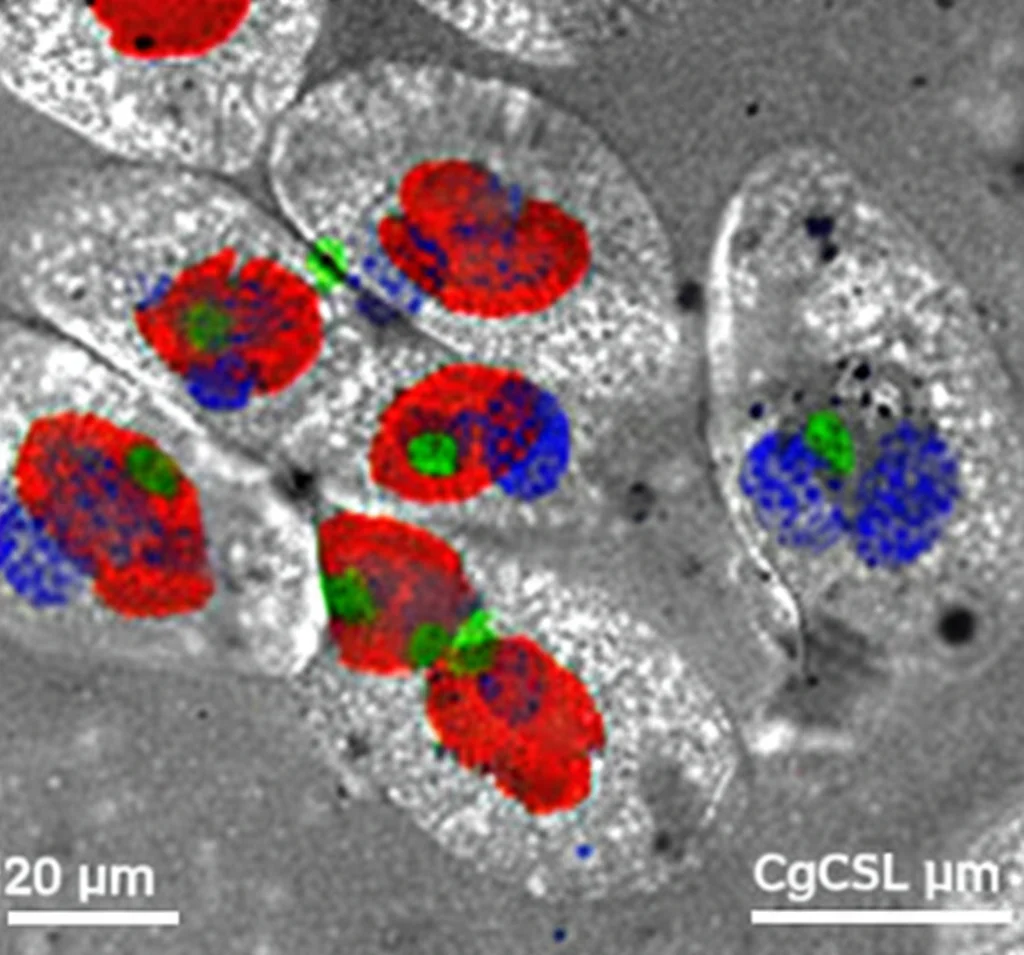
Cosa Impariamo da Questa Storia?
Questa ricerca ci svela un meccanismo di difesa immunitaria affascinante e complesso nelle ostriche. Ci mostra come una singola proteina, CgCTSL-2, possa agire da sensore specifico per un patogeno (*V. splendidus*), da attivatore del sistema del complemento (tagliando CgC3) e probabilmente anche da esecutore finale nella degradazione lisosomiale.
È una testimonianza incredibile di come l’immunità innata degli invertebrati, pur essendo diversa dalla nostra immunità adattativa (quella con anticorpi e memoria a lungo termine), sia estremamente efficace e basata su molecole e strategie conservate nel corso di milioni di anni di evoluzione. Capire questi meccanismi non è solo biologicamente affascinante, ma può anche avere implicazioni pratiche importanti per proteggere le popolazioni di ostriche, sia selvatiche che d’allevamento, dalle malattie che le minacciano.
La prossima volta che gusterete un’ostrica, pensate a questa incredibile battaglia silenziosa che avviene al suo interno, orchestrata da molecole straordinarie come la CgCTSL-2. Il mondo naturale non smette mai di sorprenderci con la sua ingegnosità!
Fonte: Springer