Paratubercolosi Ovina: Il Nostro Viaggio nel Primo Modello Sperimentale Cinese!
Ciao a tutti! Oggi voglio raccontarvi un’avventura scientifica davvero affascinante, un percorso che ci ha portati a creare qualcosa di inedito qui in Cina: il primo modello sperimentale per studiare la paratubercolosi (PTB) nelle pecore, utilizzando un ceppo batterico isolato proprio da pecore locali.
Avete mai sentito parlare della paratubercolosi? È una malattia un po’ subdola, causata da un batterio chiamato Mycobacterium avium subsp. paratuberculosis (MAP, per gli amici). Colpisce principalmente i ruminanti, sia domestici che selvatici, causando un’infiammazione cronica dell’intestino che porta a dimagrimento progressivo, diarrea e, nei casi peggiori, alla morte. Una vera spina nel fianco per gli allevatori, con un impatto economico non indifferente e serie preoccupazioni per il benessere animale.
Ma non è tutto: c’è il sospetto che il MAP possa avere un ruolo anche in alcune malattie umane, come il morbo di Crohn, e può contaminare carne, latte e acqua, entrando così nella nostra catena alimentare. Insomma, un problema da non sottovalutare!
La Sfida: Perché un Modello Sperimentale?
Uno dei problemi principali con la PTB è che diagnosticarla precocemente è difficilissimo. Gli animali si infettano da giovani, spesso ingerendo materiale contaminato dalle feci, latte o colostro, ma i sintomi possono comparire anche anni dopo. Questo rende la prevenzione, il controllo e l’eradicazione della malattia estremamente complicati.
Ecco perché avere un buon modello animale è fondamentale. Ci permette di studiare da vicino come l’infezione progredisce, di identificare dei “marcatori” precoci della malattia e, importantissimo, di testare nuovi vaccini e farmaci. Pensateci: è come avere un “campo di prova” controllato per capire meglio il nemico (il MAP) e affinare le nostre armi (diagnosi e terapie).
Fino ad ora, molti paesi avevano sviluppato modelli sperimentali, soprattutto usando bovini, pecore, topi, conigli… ma in Cina mancava ancora questo tassello fondamentale, specialmente per le pecore, che sono ospiti naturali del MAP e rappresentano un modello ideale per la ricerca: più economiche, facili da gestire e geneticamente più omogenee rispetto ad altri animali.
La Nostra Missione: Creare il Modello Cinese
Così, ci siamo rimboccati le maniche! Abbiamo selezionato nove agnellini di razza Small-tail Han di 3 mesi, provenienti da un allevamento che sapevamo essere indenne da PTB (lo avevamo controllato per anni!). Ci siamo assicurati che fossero negativi anche per altre malattie come brucellosi e tubercolosi.
Li abbiamo divisi in tre gruppi:
- Gruppo A (Controllo): Tre agnelli che non avrebbero ricevuto il batterio.
- Gruppo B (Inoculato – Dose Bassa): Tre agnelli a cui avremmo somministrato una certa dose di MAP.
- Gruppo C (Inoculato – Dose Alta): Tre agnelli a cui avremmo somministrato una dose più alta di MAP.
Il batterio che abbiamo usato era un ceppo di MAP di tipo II (chiamato MAP-NM5), isolato proprio da pecore qui in Cina e coltivato con cura nel nostro laboratorio. Per quattro giorni consecutivi, abbiamo somministrato oralmente il MAP agli agnelli dei gruppi B e C, mentre al gruppo di controllo abbiamo dato solo il terreno di coltura liquido.

Osservare i Segnali: Cosa Abbiamo Visto Giorno per Giorno?
Da quel momento è iniziata la fase di osservazione, durata ben 255 giorni. Abbiamo monitorato attentamente i nostri agnelli, annotando qualsiasi segno clinico. Cosa abbiamo notato? Beh, tutti e sei gli agnelli infettati (gruppi B e C) hanno mostrato un certo dimagrimento rispetto al gruppo di controllo, con il pelo più secco e opaco. Due di loro hanno anche avuto episodi di feci molli intermittenti, anche se non la classica diarrea grave associata alla PTB in stadio avanzato. Questo ci ricorda che nelle pecore i sintomi possono essere più sfumati e comparire tardi.
Ma non ci siamo fermati all’osservazione esterna! Abbiamo raccolto regolarmente campioni di feci e sangue.
- Feci: Già nei primissimi giorni dopo l’inoculo, abbiamo trovato MAP nelle feci, ma questo era probabilmente solo il batterio “di passaggio”. La vera sorpresa è arrivata dal 60° giorno in poi: abbiamo iniziato a rilevare MAP in modo intermittente nelle feci degli animali infetti, usando sia la PCR (una tecnica molecolare molto sensibile) che la coltura batterica. Questo significava che l’infezione si era stabilita e il batterio si stava moltiplicando! La PCR si è rivelata più sensibile della coltura, che richiede settimane per dare risultati e può essere influenzata da vari fattori.
- Sangue: Anche nel sangue abbiamo trovato tracce di MAP (tramite PCR) in modo intermittente in diversi animali infetti, soprattutto nelle fasi iniziali dopo l’inoculo. Questo suggerisce che il batterio può entrare nel circolo sanguigno, anche se forse solo temporaneamente e a bassi livelli (batteriemia transitoria).
- Anticorpi: Abbiamo cercato gli anticorpi specifici contro il MAP nel siero usando il test ELISA. Qui i risultati sono stati più elusivi: solo due pecore (una del gruppo B e una del C) sono risultate positive, e solo in alcuni momenti. Questo conferma che la risposta anticorpale nella PTB può essere tardiva e variabile, rendendo l’ELISA poco affidabile per la diagnosi precoce.
- Risposta Immunitaria Cellulare: Abbiamo misurato due importanti messaggeri del sistema immunitario: l’Interferone-gamma (IFN-γ) e l’Interleuchina-10 (IL-10). E qui le cose si sono fatte interessanti! Nei gruppi infetti, i livelli di IFN-γ sono aumentati significativamente rispetto al controllo già dal 60° giorno, raggiungendo un picco tra 105 e 135 giorni, per poi stabilizzarsi a livelli comunque alti. L’IL-10, invece, ha iniziato ad aumentare più tardi, dal 120° giorno, e ha mostrato una tendenza continua alla crescita. Questo “switch” nella risposta immunitaria (da una dominata dall’IFN-γ, tipica della fase iniziale, a una più influenzata dall’IL-10) è un aspetto cruciale della patogenesi della PTB e questi due messaggeri potrebbero diventare bersagli utili per monitorare la progressione della malattia.

Dentro l’Infezione: Le Scoperte Finali alla Necropsia
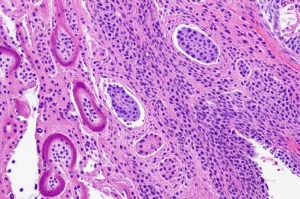
Dopo 255 giorni, abbiamo concluso l’esperimento e abbiamo eseguito l’autopsia sugli animali. Nel gruppo di controllo, tutto normale. Ma nei gruppi B e C, le lesioni erano evidenti. L’intestino, soprattutto il digiuno e l’ileo (l’ultima parte dell’intestino tenue), appariva ispessito, contratto, con la mucosa che formava pieghe diffuse, quasi come le circonvoluzioni del cervello (aspetto “a giro di cervello” o “gyrus-like”). Anche i linfonodi mesenterici (quelli che drenano l’intestino) erano ingrossati, a volte con piccole calcificazioni visibili al taglio.
Ma è stato l’esame al microscopio (istopatologia) a rivelare la vera battaglia in corso. Abbiamo usato colorazioni speciali (Ematossilina-Eosina e Ziehl-Neelsen, quest’ultima specifica per i micobatteri). Le lesioni più gravi erano nell’ileo: qui abbiamo trovato un’infiammazione granulomatosa diffusa. Cosa significa? C’erano accumuli di cellule immunitarie, soprattutto macrofagi (le cellule “spazzine” che cercano di inglobare i batteri), cellule epitelioidi (macrofagi modificati) e linfociti. In alcune aree c’erano anche cellule giganti multinucleate (formate dalla fusione di più macrofagi). E, cosa più importante, usando la colorazione di Ziehl-Neelsen, abbiamo visto che tantissimi macrofagi erano letteralmente pieni zeppi di batteri MAP (visibili come bastoncelli rossi). Questo tipo di lesione viene definita “multibacillare” (grado 3, secondo le classificazioni standard), indicando un’infezione attiva e severa. Abbiamo trovato lesioni simili, anche se meno gravi, in altre parti dell’intestino e nei linfonodi mesenterici. Addirittura, in alcuni animali, abbiamo trovato piccoli granulomi anche nel fegato!
Abbiamo anche usato la microscopia elettronica a trasmissione per vedere ancora più da vicino: abbiamo potuto osservare i batteri MAP, sia intatti che parzialmente degradati, all’interno dei macrofagi e delle cellule giganti.
Infine, abbiamo misurato la “carica batterica” (Bacterial Organ Burden – BOB) in diversi organi usando la qPCR. Indovinate dove era più alta? Esatto, nell’ileo! Ma livelli significativi sono stati trovati anche nel digiuno, nel cieco, nei linfonodi mesenterici e persino nelle tonsille, confermando che le tonsille possono essere un’altra porta d’ingresso per il MAP.

Cosa Abbiamo Imparato? Il Significato della Nostra Ricerca
Questo studio, il primo del suo genere in Cina, ci ha permesso di stabilire con successo un modello sperimentale di paratubercolosi ovina usando un ceppo locale di MAP. Abbiamo confermato che:
- Le pecore infettate sviluppano lesioni caratteristiche, soprattutto nell’ileo.
- La diagnosi precoce è complessa: la PCR su feci e tessuti è più sensibile della coltura, mentre l’ELISA per gli anticorpi è poco affidabile nelle fasi iniziali. Serve un approccio combinato!
- La risposta immunitaria cambia nel tempo, con un aumento iniziale di IFN-γ seguito da un aumento di IL-10, che potrebbero essere usati come indicatori della progressione.
- La gravità delle lesioni nell’ileo e la presenza di lesioni multibacillari sono indicatori chiave dell’infezione attiva.
Questo modello apre ora la strada a nuove ricerche qui in Cina. Potremo studiare più a fondo come il MAP interagisce con l’ospite, testare l’efficacia di nuovi metodi diagnostici (magari basati proprio su IFN-γ e IL-10?) e valutare potenziali vaccini o trattamenti. È stato un viaggio lungo e impegnativo, ma siamo entusiasti dei risultati e delle prospettive future per combattere questa malattia così sfuggente!
Fonte: Springer