PPARγ: Il Regista Segreto che Protegge i Reni dall’Ostruzione
Ciao a tutti! Oggi voglio parlarvi di qualcosa di veramente affascinante che sta succedendo nel mondo della ricerca renale. Avete presente l’ostruzione delle vie urinarie (UTO)? È un problema piuttosto comune, sia negli adulti (magari per calcoli o altre cause) sia nei bambini (spesso per motivi congeniti), e può fare danni seri ai reni, portando a malattie croniche e, nei casi peggiori, alla necessità di dialisi o trapianto.
La cosa strana, e che ci ha sempre incuriosito, è che non tutti reagiscono allo stesso modo. Alcune persone sembrano cavarsela meglio di altre di fronte a un’ostruzione. Questo ci ha fatto pensare: devono esserci dei meccanismi nascosti, dei sistemi di difesa naturali che proteggono il rene, o al contrario, che accelerano il danno. E indovinate un po’? Sembra che abbiamo trovato uno dei protagonisti principali di questa storia: un attore molecolare chiamato PPARγ (che sta per Peroxisome Proliferator-Activated Receptor γ).
Il Muro di Difesa del Rene: L’Urotelio e le Uroplachine
Prima di arrivare a PPARγ, facciamo un passo indietro. Dovete sapere che il rene non è solo un filtro passivo. Ha un rivestimento interno, chiamato urotelio renale, un po’ diverso da quello della vescica o degli ureteri. Studi precedenti avevano già mostrato una cosa incredibile: quando c’è un’ostruzione, sia congenita che acquisita, l’urotelio renale mette in moto un programma di “ristrutturazione” protettivo.
In pratica, inizia a espandere un particolare tipo di cellule, chiamate cellule UPK+ (perché esprimono proteine chiamate Uroplachine – UPK). Queste uroplachine (UPK1A, UPK1B, UPK2, UPK3A) si assemblano sulla superficie delle cellule formando delle specie di “placche” che rendono l’urotelio più resistente e impermeabile, un po’ come quello della vescica. È come se il rene, sentendosi sotto pressione, cercasse di rinforzare le sue mura!
Esperimenti precedenti hanno dimostrato che se si eliminano queste cellule UPK+ o si danneggiano le placche di uroplachina, il danno al rene durante l’ostruzione peggiora drasticamente. Quindi, queste cellule e le loro placche sono fondamentali per mantenere l’integrità strutturale del rene sotto stress. Ma la domanda rimaneva: chi dirige questa operazione di rinforzo? Come fa il rene a sapere che deve produrre più cellule UPK+ e più uroplachine?
I Veri Eroi della Riparazione: Le Cellule UPK+ si Rimboccano le Maniche
Una delle prime cose che abbiamo voluto capire era da dove venissero queste nuove cellule UPK+ durante l’ostruzione. Si pensava che potessero derivare da altre cellule progenitrici presenti nell’urotelio, le cellule KRT5+. Ma le nostre ricerche precedenti avevano suggerito che, almeno negli adulti, queste cellule KRT5+ non erano le principali responsabili della formazione delle nuove cellule UPK+.
Allora, chi erano i veri “operai” della riparazione? Usando tecniche sofisticate di tracciamento del lignaggio (in pratica, mettendo un’etichetta fluorescente sulle cellule UPK+ esistenti e vedendo cosa succedeva loro durante l’ostruzione) e analizzando dati di sequenziamento dell’RNA a singola cellula (sciRNA-seq), abbiamo fatto una scoperta sorprendente.
Abbiamo visto che durante le prime fasi dell’ostruzione (giorno 1-2), le cellule UPK+ esistenti perdevano temporaneamente l’espressione delle uroplachine (come se si “spogliassero” per prepararsi a un nuovo compito) e, incredibilmente, iniziavano a proliferare! Sì, proprio loro, le cellule che pensavamo fossero solo parte del “muro”, si trasformavano in cellule capaci di dividersi e creare nuove cellule. Poi, nei giorni successivi (dal giorno 7 in poi), queste cellule “figlie” riacquistavano l’espressione delle uroplachine, ricostituendo e rinforzando lo strato protettivo.
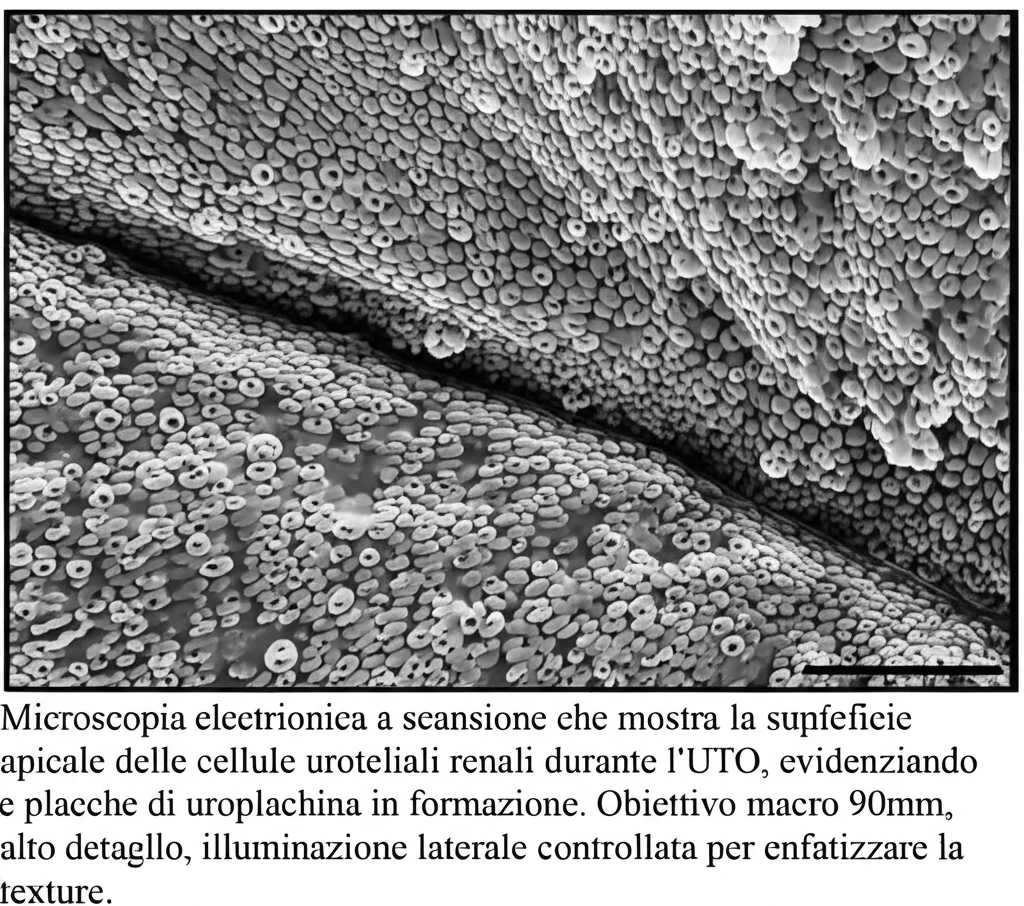
Insomma, le cellule UPK+ non sono solo mattoni passivi, ma veri e propri progenitori della riparazione tissutale nell’urotelio renale adulto durante l’UTO. Una scoperta che cambia un po’ le carte in tavola e ci fa capire quanto sia dinamico questo tessuto!
Il Direttore d’Orchestra: Ecco che Entra in Scena PPARγ
Ok, le cellule UPK+ si danno da fare, ma chi dà loro l’ordine di proliferare e poi di produrre più uroplachine? Analizzando i dati di espressione genica nelle singole cellule UPK+ durante l’UTO, abbiamo notato che molti geni attivati erano collegati a un particolare fattore di trascrizione: il nostro PPARγ.
PPARγ è già noto per essere un “regista” della differenziazione cellulare in molti tessuti, incluso l’urotelio della vescica, dove promuove proprio l’espressione delle uroplachine. Ma nessuno aveva mai studiato il suo ruolo nell’urotelio renale, specialmente durante un’ostruzione.
Abbiamo quindi esaminato più da vicino cosa succedeva a PPARγ nei reni ostruiti. E la scoperta è stata netta:
- Nei reni sani (controllo), PPARγ era quasi assente nell’urotelio renale (a differenza della vescica, dove è sempre presente).
- Durante l’UTO (al giorno 7), l’espressione di PPARγ aumentava significativamente, e si localizzava proprio nei nuclei delle cellule UPK+!
- Non solo aumentava PPARγ, ma aumentava anche l’espressione di un suo bersaglio diretto, la proteina FABP4, segno che PPARγ non era solo presente, ma anche attivo.
- Abbiamo anche visto un aumento di GRHL3, un altro fattore di trascrizione noto per essere regolato da PPARγ e per promuovere la differenziazione uroteliale e l’espressione di UPK2.
Quindi, sembrava proprio che l’ostruzione attivasse PPARγ specificamente nelle cellule UPK+, e che questo fosse collegato all’aumento delle uroplachine. Era lui il direttore d’orchestra che stavamo cercando?
La Prova del Nove: Spegnere e Accendere PPARγ
Per essere sicuri che PPARγ fosse davvero la causa e non solo una coincidenza, abbiamo fatto degli esperimenti più diretti usando modelli animali geneticamente modificati.
Esperimento 1: Spegnere PPARγ (Loss-of-Function – LOF)
Abbiamo creato topi in cui potevamo “spegnere” il gene Pparg specificamente nelle cellule UPK+ dopo aver indotto l’ostruzione (UTO). Cosa è successo?
- L’espressione di PPARγ e del suo bersaglio FABP4 è crollata nell’urotelio.
- Anche l’espressione di GRHL3 è diminuita significativamente.
- Di conseguenza, l’espressione delle proteine uroplachine (UPK1A, UPK1B, UPK3A) è stata fortemente ridotta.
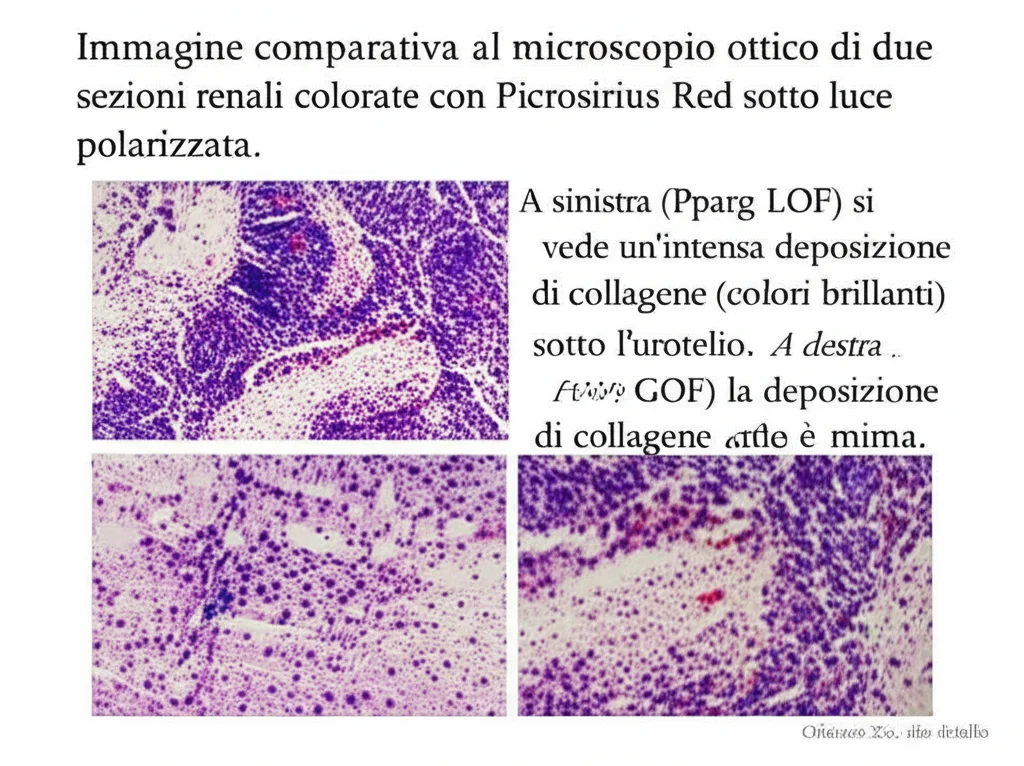
- E il risultato sul rene? Il parenchima renale (la parte funzionale del rene) si è assottigliato molto di più rispetto ai topi di controllo con UTO. C’era anche un aumento del collagene subito sotto l’urotelio.
In pratica, togliendo PPARγ, abbiamo bloccato il rinforzo dell’urotelio e peggiorato il danno strutturale al rene.
Esperimento 2: Accendere PPARγ (Gain-of-Function – GOF)
Poi abbiamo fatto l’opposto. Abbiamo usato topi in cui potevamo “accendere” forzatamente PPARγ nelle cellule UPK+, rendendolo attivo anche senza il suo normale segnale di attivazione. E i risultati?
- L’attività di PPARγ (misurata tramite FABP4) è aumentata notevolmente.
- L’espressione di GRHL3 è aumentata.
- L’espressione delle uroplachine (UPK1A, UPK1B, UPK3A) è aumentata significativamente rispetto ai controlli con UTO.
- E l’effetto sul rene? Il parenchima renale è stato preservato! Era significativamente più spesso rispetto ai topi di controllo con UTO. Inoltre, il collagene sotto l’urotelio era diminuito.
Accendendo PPARγ, abbiamo potenziato il meccanismo di difesa dell’urotelio e protetto la struttura del rene!
Cosa Significa Tutto Questo? Nuove Speranze Terapeutiche!
Questi risultati sono davvero entusiasmanti! Dimostrano che PPARγ è un regolatore chiave del rimodellamento protettivo dell’urotelio renale durante l’ostruzione delle vie urinarie. Agisce probabilmente attraverso GRHL3 per aumentare l’espressione delle uroplachine, rinforzando così l’urotelio e aiutando a preservare la struttura del parenchima renale.
La cosa ancora più interessante è che esistono già farmaci che attivano PPARγ, come i tiazolidinedioni usati per il diabete (es. pioglitazone, rosiglitazone). Studi precedenti avevano già suggerito che questi farmaci potessero avere effetti protettivi sul rene in modelli di UTO, riducendo infiammazione e fibrosi. Il nostro lavoro aggiunge un pezzo fondamentale al puzzle, mostrando che un meccanismo chiave di questa protezione potrebbe passare proprio attraverso il potenziamento dell’urotelio mediato da PPARγ.
Certo, la strada è ancora lunga. Dobbiamo capire meglio come l’aumento delle uroplachine protegga esattamente il parenchima (maggiore resistenza meccanica? Migliore barriera? Effetti anti-infiammatori indiretti?). Dobbiamo capire cosa attiva PPARγ endogenamente durante l’UTO (forse qualche metabolita delle prostaglandine presente nell’urina?). E soprattutto, dobbiamo verificare se attivare PPARγ con farmaci possa essere una strategia terapeutica efficace e sicura per prevenire o mitigare il danno renale nei pazienti con UTO, sia acquisita che congenita. Serviranno studi su modelli più complessi, come quelli di ostruzione reversibile o di UTO congenita, dove potremo valutare anche la funzione renale.
Ma per ora, abbiamo identificato un nuovo, importante meccanismo di difesa del rene e un potenziale bersaglio terapeutico. È la dimostrazione che a volte, le risposte più importanti si nascondono nei posti più inaspettati, come nel sottile rivestimento interno del nostro rene!
Fonte: Springer