Piastrine Superpotenziate: Come le Stiamo Programmando per Diventare Corrieri di Proteine Terapeutiche!
Avete mai pensato alle piastrine? Quelle minuscole cellule nel nostro sangue, famose soprattutto per fermare le emorragie? Beh, tenetevi forte, perché sto per raccontarvi come stiamo cercando di trasformarle in qualcosa di molto più… *programmabile*. Immaginate di poterle usare come dei veri e propri corrieri specializzati, capaci di trasportare e consegnare proteine terapeutiche esattamente dove servono nel corpo. Sembra fantascienza, vero? Eppure, è proprio quello su cui stiamo lavorando!
Le Piastrine: Molto Più Che Semplici “Tappi”
Le piastrine sono cellule affascinanti. Non hanno un nucleo, il che le rende “sicure” dal punto di vista genetico – nessun rischio che DNA estraneo si integri nel nostro genoma. Ma la cosa più incredibile è che sono naturalmente piene zeppe di granuli secretori, piccole “sacche” che contengono un’enorme quantità di proteine. Normalmente, queste proteine vengono rilasciate in risposta a segnali specifici, come una ferita, per aiutare nella coagulazione e nella guarigione.
La nostra idea è stata: e se potessimo “dirottare” questo meccanismo naturale? Se potessimo insegnare alle piastrine a caricare e trasportare proteine *non* native, proteine progettate da noi per scopi terapeutici?
La Sfida: Come Programmare una Cellula Senza Nucleo?
Qui arriva il bello. Non possiamo modificare direttamente le piastrine mature, proprio perché non hanno nucleo e quindi non possiamo inserirci nuove istruzioni genetiche in modo stabile. Allora, come fare? Semplice (si fa per dire!): andiamo alla fonte!
Le piastrine nascono da cellule progenitrici molto più grandi e complesse chiamate megacariociti (MK). Questi giganti cellulari si trovano nel midollo osseo e sono loro i veri “genitori” delle piastrine. I megacariociti *hanno* un nucleo e possono essere coltivati e modificati geneticamente in laboratorio.
Quindi, la strategia è:
- Prendere cellule ancora più “giovani”, le cellule staminali pluripotenti (che possono diventare qualsiasi tipo di cellula). Queste sono fantastiche perché possiamo coltivarle indefinitamente e modificarle geneticamente con relativa facilità.
- Indurre queste cellule staminali a differenziarsi, passo dopo passo, fino a diventare megacariociti.
- Durante questo processo di differenziamento, inserire nei megacariociti le istruzioni genetiche per produrre la proteina terapeutica che ci interessa.
- Lasciare che i megacariociti “maturino” e inizino a produrre piastrine. Queste piastrine erediteranno il carico proteico programmato!
Creare Piastrine “Su Misura” in Laboratorio
Abbiamo sviluppato una procedura dettagliata (una vera e propria “pipeline”) per far avvenire tutto questo *in vitro*, partendo da cellule staminali embrionali di topo (mESCs). Il processo prevede diversi passaggi, inclusa la coltivazione su cellule specifiche (chiamate OP9) e l’aggiunta di un fattore di crescita fondamentale, la trombopoietina (TPO), che spinge le cellule verso il destino di megacariociti.
Dopo circa 12-16 giorni, otteniamo megacariociti maturi che iniziano a rilasciare piastrine nel terreno di coltura. Possiamo riconoscere queste cellule e le piastrine derivate grazie a marcatori specifici sulla loro superficie, come il CD41. E, cosa fondamentale, abbiamo verificato che queste piastrine prodotte in laboratorio sono funzionali: si attivano se esposte a trombina e ADP (segnali classici di attivazione), proprio come quelle naturali, esprimendo un altro marcatore chiamato P-selectina.
Scalare la Produzione: Dai Piatti ai Bioreattori
Una delle grandi sfide delle terapie cellulari è produrre numeri sufficienti di cellule. Per una trasfusione in un paziente adulto servono centinaia di miliardi di piastrine! La coltivazione tradizionale in piastre 2D non basta.
Per superare questo ostacolo, abbiamo testato l’uso di bioreattori spinner flask. Si tratta di contenitori speciali dove il terreno di coltura viene mantenuto in movimento, creando delle forze di taglio simili a quelle presenti nel flusso sanguigno. Queste forze meccaniche aiutano i megacariociti a rilasciare più piastrine. E i risultati sono stati ottimi! Ottimizzando i tempi di maturazione dei megacariociti (abbiamo scoperto che 16 giorni funzionano meglio dei 12 iniziali) e trasferendoli poi nei bioreattori per 3 giorni, siamo riusciti ad aumentare la produzione di piastrine di oltre 50 volte rispetto alla coltura statica. Questo approccio funziona anche con linee cellulari umane (come le MEG-01, derivate da leucemia megacarioblastica), dimostrando il potenziale di scalabilità.
Ingegnerizzare il Carico: Due Modi per Consegnare Proteine
Ora, la parte più eccitante: caricare le proteine “straniere”. Abbiamo provato due strategie principali.
1. Carico nei Granuli Alfa per Rilascio Controllato:
Come dicevo, le piastrine hanno questi granuli alfa pieni di proteine. Abbiamo scoperto che, aggiungendo una piccola sequenza “segnale” (derivata da una citochina umana chiamata RANTES) alla nostra proteina d’interesse, possiamo indirizzarla specificamente verso questi granuli durante la formazione delle piastrine nei megacariociti.
Per dimostrarlo, abbiamo usato una proteina reporter chiamata SEAP (fosfatasi alcalina secreta). Quando la SEAP era prodotta normalmente nel megacariocita, veniva rilasciata costantemente nel mezzo. Ma quando abbiamo aggiunto il segnale RANTES, la SEAP veniva trattenuta all’interno delle piastrine (nei granuli alfa) e rilasciata solo *dopo* aver attivato le piastrine con trombina/ADP. Questo apre la porta a terapie dove il farmaco viene rilasciato solo in condizioni specifiche, ad esempio nel sito di un coagulo o di un’infiammazione.
2. Carico nel Citoplasma per Modifica Cellulare:
E se volessimo consegnare una proteina che deve agire *dentro* altre cellule? Abbiamo pensato a questo usando la Cre ricombinasi, un enzima capace di “tagliare e cucire” il DNA in punti specifici (chiamati siti loxP).
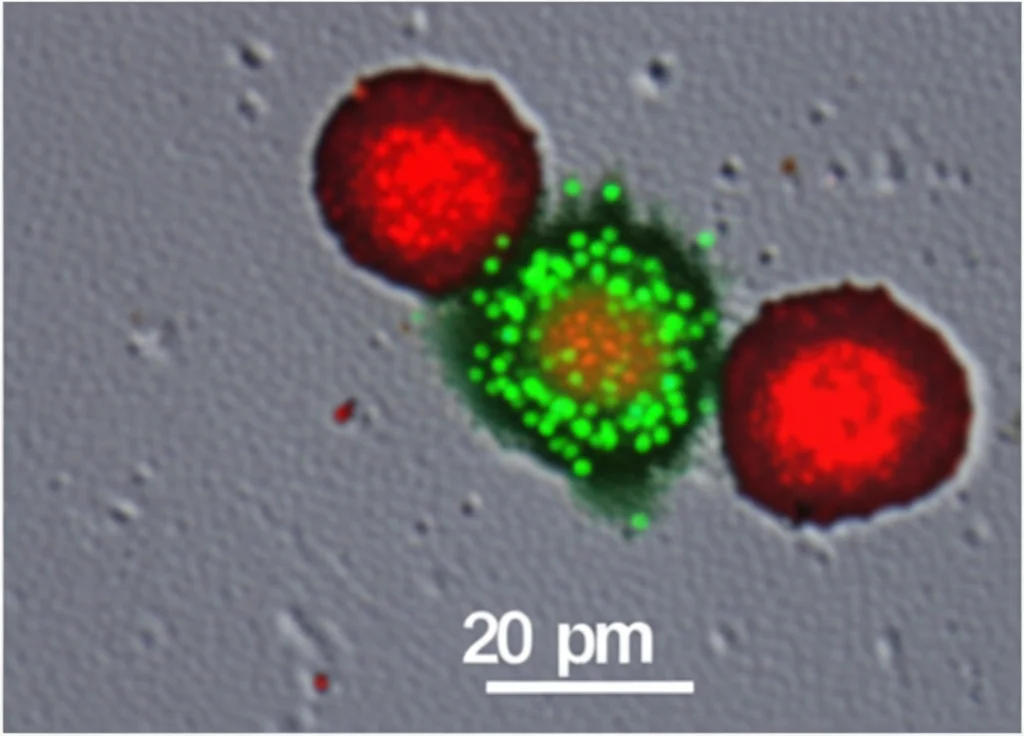
Abbiamo modificato i megacariociti per produrre una versione della Cre ricombinasi che rimane nel citoplasma (Cre-ER, attivabile con tamoxifene). Le piastrine prodotte da questi MK si sono riempite di Cre-ER. Poi, abbiamo messo queste piastrine “cariche” a contatto con cellule reporter (cellule HEK293) che avevano una costruzione genetica particolare: esprimevano una proteina fluorescente verde (GFP), ma se la Cre ricombinasi fosse entrata nella cellula e avesse fatto il suo lavoro, avrebbero smesso di produrre GFP e iniziato a produrre una proteina fluorescente rossa (RFP).
Ebbene, dopo aver aggiunto le piastrine cariche di Cre-ER e il tamoxifene per attivarla, le cellule reporter hanno iniziato a diventare rosse! Questo significa che le piastrine sono riuscite a consegnare l’enzima funzionante alle cellule bersaglio, probabilmente venendo “inghiottite” (fagocitate) o rilasciando microparticelle contenenti la Cre. Questa è una dimostrazione potentissima della possibilità di usare le piastrine per modificare geneticamente altre cellule *in vivo*.
Il Futuro è Programmato nelle Piastrine?
Questi studi aprono scenari davvero intriganti. Stiamo dimostrando che è possibile:
- Produrre piastrine funzionali su larga scala partendo da cellule staminali pluripotenti.
- Programmare queste piastrine per caricare proteine non native.
- Scegliere come queste proteine verranno consegnate: rilascio controllato dopo attivazione o trasferimento diretto ad altre cellule.
Le applicazioni potenziali sono enormi. Potremmo usare queste piastrine ingegnerizzate per:
- Fornire enzimi metabolici mancanti in malattie genetiche.
- Consegnare farmaci direttamente ai tumori per bloccarne la crescita.
- Modulare la risposta immunitaria in malattie autoimmuni o infiammatorie.
- Prevenire l’aterosclerosi consegnando agenti che sciolgono le placche.
Certo, ci sono ancora sfide da affrontare, come migliorare l’efficienza della modificazione genetica, evitare che il “carico” interferisca con la produzione stessa delle piastrine, e garantire la sicurezza a lungo termine. Potremmo usare promotori specifici dei megacariociti o circuiti genetici inducibili per controllare meglio l’espressione delle proteine terapeutiche. Inoltre, si sta lavorando per creare linee di cellule staminali pluripotenti “universali” (modificando il loro sistema HLA) per evitare problemi di rigetto.
Ma la strada è tracciata. Stiamo imparando a sfruttare le incredibili capacità naturali delle piastrine, combinandole con gli strumenti dell’ingegneria cellulare e della biologia sintetica. L’idea di avere questi minuscoli “droni” biologici programmabili che navigano nel nostro corpo per consegnare terapie mirate non è più solo un sogno. È una possibilità concreta che stiamo costruendo, esperimento dopo esperimento. E non vedo l’ora di vedere dove ci porterà!
Fonte: Springer