Ammoniaca: Il Segreto è nelle Perle! Come Carbonio Attivo e Cloruro di Calcio Stanno Rivoluzionando lo Stoccaggio del Freddo
Ciao a tutti, appassionati di scienza e innovazione! Oggi voglio parlarvi di una scoperta che mi ha davvero entusiasmato e che potrebbe dare una svolta significativa ai sistemi di raffreddamento, rendendoli più efficienti e amici dell’ambiente. Immaginate di poter immagazzinare il “freddo” in modo super efficace, proprio come si fa con l’energia. Sembra fantascienza? Beh, non proprio, e il protagonista di questa storia è un gas che conosciamo bene: l’ammoniaca.
L’ammoniaca, infatti, è un eccellente mezzo per lo stoccaggio di energia termica fredda (CTES), grazie alla sua disponibilità, al basso costo e a una capacità di stoccaggio (calore latente di evaporazione) che fa impallidire i materiali tradizionali a cambiamento di fase. Parliamo di 4-6 volte superiore! Il trucco sta nell’adsorbirla quando c’è poca richiesta di freddo e rilasciarla nei momenti di picco. Ma come fare per “catturarla” al meglio?
La Sfida dei Materiali Adsorbenti: Polveri vs. Strutture
Qui entrano in gioco i materiali adsorbenti. Tra i candidati più promettenti ci sono i sali alogenuri metallici, come il cloruro di calcio (CaCl2), che hanno una grande affinità con l’ammoniaca. Il problema è che, da soli, questi sali tendono a gonfiarsi e ad agglomerarsi, ostacolando il trasferimento di calore e massa. Una soluzione è impregnare materiali mesoporosi, come il carbone attivo (AC), con questi sali. Il carbone attivo è fantastico: poroso, sostenibile e un ottimo “vettore” per i sali.
Studi recenti hanno confermato che i compositi a base di carbone attivo sono efficaci per l’adsorbimento di ammoniaca. Tuttavia, c’è un “ma” grande come una casa quando si passa dal laboratorio alla scala pilota: le polveri di carbone attivo presentano diversi inconvenienti. Pensateci: perdita di materiale durante i processi, agglomerazione che riduce la superficie utile e l’accessibilità ai pori, e una stabilità meccanica non proprio eccelsa. Insomma, un bel grattacapo.
E se potessimo dare una forma più “strutturata” a questi compositi? Ed è qui che la nostra ricerca, pubblicata su Springer, ha voluto fare luce. L’ipotesi era semplice ma potente: incapsulare le particelle di carbone attivo e sale in piccole perle (beads in inglese) utilizzando un legante. Questo approccio potrebbe cambiare radicalmente la chimica di superficie, la distribuzione del sale e, di conseguenza, il meccanismo di adsorbimento dell’ammoniaca.
L’Importanza della Struttura e del pH: La Nostra Indagine
Nel nostro studio, abbiamo messo a confronto il carbone attivo puro, il carbone attivo in polvere impregnato con CaCl2 e, la vera novità, delle perle di carbone attivo reticolate con CaCl2. Volevamo capire l’impatto della strutturazione, della distribuzione del sale, della porosità, dell’area superficiale e, un aspetto cruciale, del crosslinking controllato dal pH sull’adsorbimento dell’ammoniaca.
Sì, avete capito bene, il pH! Abbiamo scoperto che il pH della soluzione in cui si formano le perle gioca un ruolo fondamentale. Utilizzando una soluzione di reticolazione a pH 8, l’acido alginico (il nostro legante “verde”) si deprotona in modo ottimale, permettendo una reticolazione efficace con gli ioni Ca²⁺. Questo processo porta alla formazione di una rete ben strutturata e altamente porosa, massimizzando i siti disponibili per l’adsorbimento dell’ammoniaca.
I risultati sono stati sorprendenti! Un campione di perle contenente il 20% di CaCl2 (chiamato AC-B (20%)), reticolato a pH 8, ha mostrato una capacità di adsorbimento di ammoniaca due volte superiore rispetto al carbone attivo puro in polvere. Questo è dovuto a un crosslinking ottimale, a interazioni fisico-chimiche favorevoli e alla presenza di una quantità “sintonizzata” di cloruro di calcio sulla superficie e nei pori.

Per arrivare a queste conclusioni, abbiamo utilizzato un arsenale di tecniche di caratterizzazione: SEM (microscopia elettronica a scansione) per osservare la morfologia, XRD (diffrazione a raggi X) per l’analisi cristallina, FTIR (spettroscopia infrarossa a trasformata di Fourier) per i gruppi funzionali, BET e DFT per l’area superficiale e la porosità, e XPS (spettroscopia fotoelettronica a raggi X) per la composizione chimica superficiale. Questi strumenti ci hanno permesso di “vedere” cosa succede prima e dopo l’adsorbimento.
Dentro il Meccanismo di Adsorbimento: Cosa Ci Dicono i Modelli Cinetici
Non ci siamo fermati qui. Abbiamo analizzato i risultati sperimentali applicando modelli cinetici non lineari (Pseudo 1° ordine, Pseudo 2° ordine ed Elovich). Il modello che meglio si adattava ai nostri dati è stato il modello N-PSO (Pseudo 2° ordine non lineare), confermando il più alto trasferimento di massa per il campione in perle AC-B (20%). Questo suggerisce che le interazioni chimiche e multisito dominano il processo di adsorbimento, andando oltre le semplici interazioni fisiche.
Ma cosa succede esattamente quando l’ammoniaca incontra queste perle magiche? È un processo a due fasi: prima, un trasferimento di massa esterno, con l’ammoniaca attratta verso la superficie dell’adsorbente; poi, l’adsorbimento sui siti attivi. La chimica della superficie è quindi fondamentale.
Nel caso del carbone attivo puro, l’adsorbimento è dovuto principalmente alle forze di Van der Waals e ai gruppi funzionali superficiali (idrossilici, carbonilici). Quando aggiungiamo il CaCl2, la situazione si fa più interessante. L’ammoniaca interagisce con il CaCl2 formando un complesso calcio cloruro-ammoniaca. Lo ione calcio agisce come acido di Lewis (accetta elettroni) e l’ammoniaca come base di Lewis (dona elettroni).
Nelle perle AC-B (20%), la storia si arricchisce ulteriormente. L’acido alginico introduce ulteriori gruppi funzionali (OH, COOH, COO-, C=O) sulla superficie. Il CaCl2, inoltre, non solo reticola le catene polimeriche dell’alginato (formando il famoso “modello a scatola d’uovo” o Egg-Box Model), ma si deposita anche all’interno dei pori del carbone attivo. Questa disposizione sinergica potenzia l’interazione con l’ammoniaca sia in superficie che all’interno.
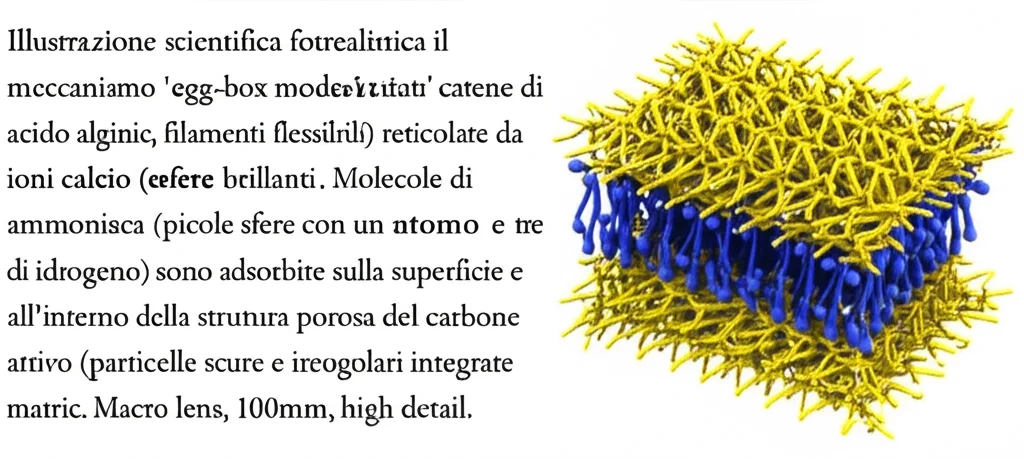
La Prova del Nove: Analisi XPS e l’Effetto del pH sull’Adsorbimento
L’analisi XPS ci ha dato una conferma cruciale: il campione in perle AC-B (20%) presenta una maggiore quantità di CaCl2 sulla superficie rispetto al campione in polvere AC-P (20%). E, cosa ancora più importante, dopo l’adsorbimento, la quantità di azoto (proveniente dall’ammoniaca) sulla superficie delle perle era significativamente più alta (5.60%) rispetto alla polvere (1.80%). Questo significa più ammoniaca adsorbita, proprio come ci aspettavamo!
Abbiamo anche investigato a fondo l’effetto del pH della soluzione di reticolazione, testando valori da 4 a 12 per il campione AC-B (20%). L’adsorbimento di ammoniaca aumentava con il pH da 4 a 8, per poi diminuire da 9 a 12. Il pH 8 si è confermato l’optimum. Perché?
- A pH bassi (<6), gli ioni calcio sono molto solubili e i gruppi funzionali dell'acido alginico (COOH) sono prevalentemente protonati. La reticolazione è insufficiente.
- A pH 6-8, i gruppi carbossilici sono parzialmente deprotonati (COO⁻). Gli ioni Ca²⁺ rimangono solubili e non precipitano come Ca(OH)2. Questo porta a una migliore reticolazione e a una porosità ottimale, specialmente microporosità.
- A pH elevati (9-12), gli ioni calcio tendono a reagire con gli ioni OH⁻ formando Ca(OH)n. Questo riduce la disponibilità di Ca²⁺ per la reticolazione e può causare la precipitazione di Ca(OH)2, bloccando o collassando la microporosità. Inoltre, un’eccessiva deprotonazione può creare forze repulsive tra i gruppi carbossilato e l’ammoniaca.
Rigenerazione e Stabilità: Le Perle Battono le Polveri
Un buon adsorbente deve essere anche facilmente rigenerabile. Abbiamo testato la desorbimento dei campioni AC-P (20%) e AC-B (20%) a diverse temperature (120°C, 140°C, 160°C e 180°C). Entrambi i campioni si rigenerano bene, specialmente tra 160°C e 180°C, rilasciando circa il 70-73% dell’ammoniaca adsorbita. Le perle mostrano una leggera minore efficienza di desorbimento, il che ha senso, data la maggiore affinità di legame dovuta ai siti attivi aggiuntivi forniti dall’acido alginico.
Ma la vera differenza l’abbiamo vista nei test di riciclabilità su cinque cicli. Le perle AC-B (20%) hanno mantenuto prestazioni di adsorbimento quasi costanti per i primi tre cicli, con un calo modesto (8.7% in totale dopo cinque cicli). La loro struttura rigida e stabile ha preservato la porosità e i siti di adsorbimento. Al contrario, il campione in polvere AC-P (20%) ha mostrato un calo drastico ad ogni ciclo, perdendo il 24% della sua capacità di adsorbimento dopo cinque cicli, probabilmente a causa dell’agglomerazione.

Un Occhio al Portafoglio e all’Ambiente
Infine, parliamo di costi e sostenibilità. I materiali che abbiamo usato (carbone attivo, cloruro di calcio, acido alginico) sono relativamente economici. Il carbone attivo costa circa 5-10 $/kg, il CaCl2 10-15 $/kg e l’acido alginico 5-15 $/kg. Confrontateli con i MOF (Metal-Organic Frameworks), altri materiali studiati per l’adsorbimento di ammoniaca, che possono costare da 500 a 10.000 $/kg! Inoltre, i nostri materiali sono ecocompatibili, a differenza di molti MOF che richiedono solventi tossici e processi di sintesi complessi ed energivori.
Conclusioni e Prospettive Future
In conclusione, il nostro studio ha dimostrato che strutturare i compositi di carbone attivo e cloruro di calcio sotto forma di perle, specialmente con un controllo attento del pH durante la formazione, può migliorare significativamente l’adsorbimento di ammoniaca. Le perle AC-B (20%) reticolate a pH 8 hanno raddoppiato la capacità di adsorbimento rispetto al carbone attivo puro e superato le prestazioni della polvere impregnata, grazie a una migliore porosità, una distribuzione ottimizzata del sale e interazioni fisico-chimiche potenziate.
Questi risultati aprono la strada a sistemi di stoccaggio del freddo più efficienti, economici e sostenibili. Certo, c’è ancora da lavorare, ma la direzione sembra quella giusta. Chissà, magari in futuro i nostri frigoriferi e condizionatori funzioneranno grazie a queste piccole, potentissime perle!
Spero che questo viaggio nel mondo dell’adsorbimento vi sia piaciuto. È affascinante vedere come la chimica dei materiali possa offrire soluzioni concrete a problemi energetici globali. Alla prossima!
Fonte: Springer







