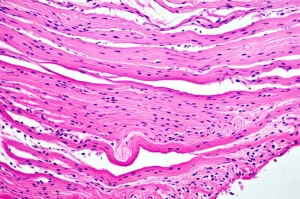
Un Cerotto Magico per il Cuore? La Scienza che Ripara l’Infarto!
Amici, mettetevi comodi perché oggi vi racconto una storia che ha dell’incredibile, una di quelle che accendono una speranza luminosa nel campo della medicina. Parliamo di cuore, il motore della nostra vita, e di come la scienza stia facendo passi da gigante per ripararlo quando un brutto giorno, un infarto, decide di metterlo a dura prova. Sapete, l’infarto miocardico acuto (IMA) è un nemico subdolo: non solo danneggia il muscolo cardiaco, ma spesso porta a insufficienza cardiaca perché il tessuto sano circostante si deteriora progressivamente a causa dello stress meccanico eccessivo. Un bel problema, vero?
Il Cuore Ferito: Una Cicatrice Difficile da Guarire
Quando il cuore subisce un infarto, è come se una parte del suo prezioso tessuto muscolare morisse. Immaginatevi perdere fino a 10 miliardi di cardiomiociti, le cellule operaie del nostro cuore! E il guaio è che il nostro corpo, da solo, fa una fatica tremenda a rimpiazzarle. Certo, esistono meccanismi endogeni di riparazione, come la proliferazione dei cardiomiociti esistenti o l’intervento di cellule progenitrici, ma sono processi lentissimi e insufficienti. Pensate che il turnover dei cardiomiociti negli adulti è limitatissimo: meno del 50% si rinnova nel corso di un’intera vita, passando dall’1% all’anno a 20 anni ad appena lo 0,3% a 75 anni! Affidarsi solo alla natura, in questo caso, non basta.
L’insufficienza cardiaca che ne deriva è una condizione progressiva, spesso terminale, che non di rado richiede un trapianto di cuore. Ma i cuori disponibili sono pochissimi, e anche quando il trapianto riesce, la sopravvivenza a lungo termine non è scontata. C’era un bisogno disperato di trovare alternative, terapie capaci di prevenire l’insufficienza cardiaca e promuovere una vera rigenerazione del miocardio. Ed è qui che entra in gioco la nostra ricerca!
L’Idea Geniale: Un “Patch” Cardiaco Intelligente
Cosa abbiamo pensato? Di dare una mano al cuore ferito con un approccio innovativo: un “patch” cardiaco, una sorta di cerotto biologico, fatto di membrana amniotica acellulare (privata cioè delle sue cellule originali per evitare rigetti) e fibrina, arricchito con una squadra speciale di cellule. Nello specifico, abbiamo usato cellule staminali amniotiche porcine (pASC) e cardiomiociti porcini autologhi (pCardios), cioè prelevati dallo stesso animale. Le cellule amniotiche sono fantastiche: facili da ottenere, con pochi problemi etici, pluripotenti (cioè capaci di trasformarsi in diversi tipi di cellule), poco immunogeniche e con un grande potenziale rigenerativo.
Per il nostro studio, abbiamo coinvolto dei maialini (un modello animale molto simile all’uomo per quanto riguarda il sistema cardiovascolare) di 2-4 mesi. Abbiamo indotto un infarto miocardico acuto e poi li abbiamo divisi in tre gruppi:
- Un gruppo di controllo (solo infarto, nessuna cura).
- Un gruppo trattato solo con le cellule staminali amniotiche (pASC).
- Un gruppo “cocultura”, trattato con una combinazione di pASC e cardiomiociti (pCardios).
Il patch veniva applicato epicardicamente (sulla superficie esterna del cuore), e le cellule venivano anche iniettate nel muscolo cardiaco tramite plasma ricco di piastrine (PRP). Dopo otto settimane, siamo andati a vedere cosa era successo.
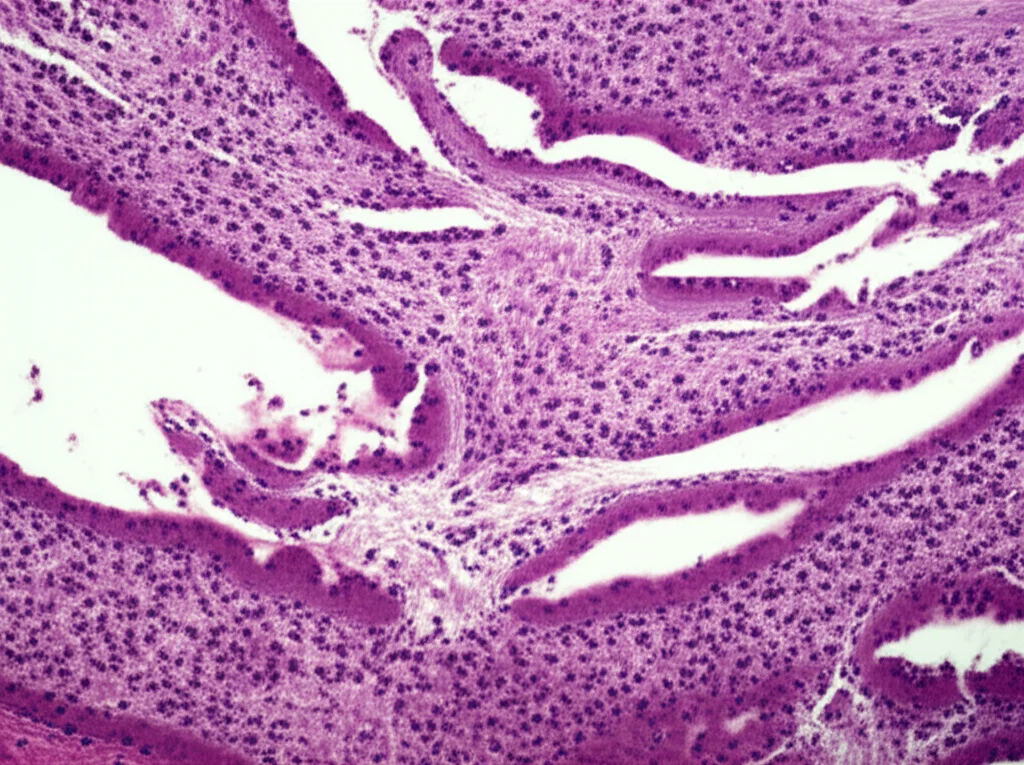
Risultati da Batticuore: La Cocultura Vince!
Ebbene, i risultati sono stati sorprendenti, soprattutto nel gruppo cocultura!
Innanzitutto, il movimento regionale della parete ventricolare (RWMA), un indice di come si contrae il cuore, è migliorato nel 60% dei maialini del gruppo cocultura, nel 25% del gruppo pASC, e in nessuno del gruppo controllo. Un segnale importantissimo che qualcosa di buono stava accadendo!
L’analisi istologica, cioè l’esame dei tessuti al microscopio, ha rivelato che nel gruppo di controllo c’era una fibrosi estesa (cioè tante cicatrici) e persino lipomatosi (accumulo di grasso) al centro dell’infarto. Un disastro. Invece, nei gruppi trattati con pASC e, soprattutto, nel gruppo cocultura, la cicatrice fibrotica era minima, sia al centro che ai bordi dell’area infartuata.
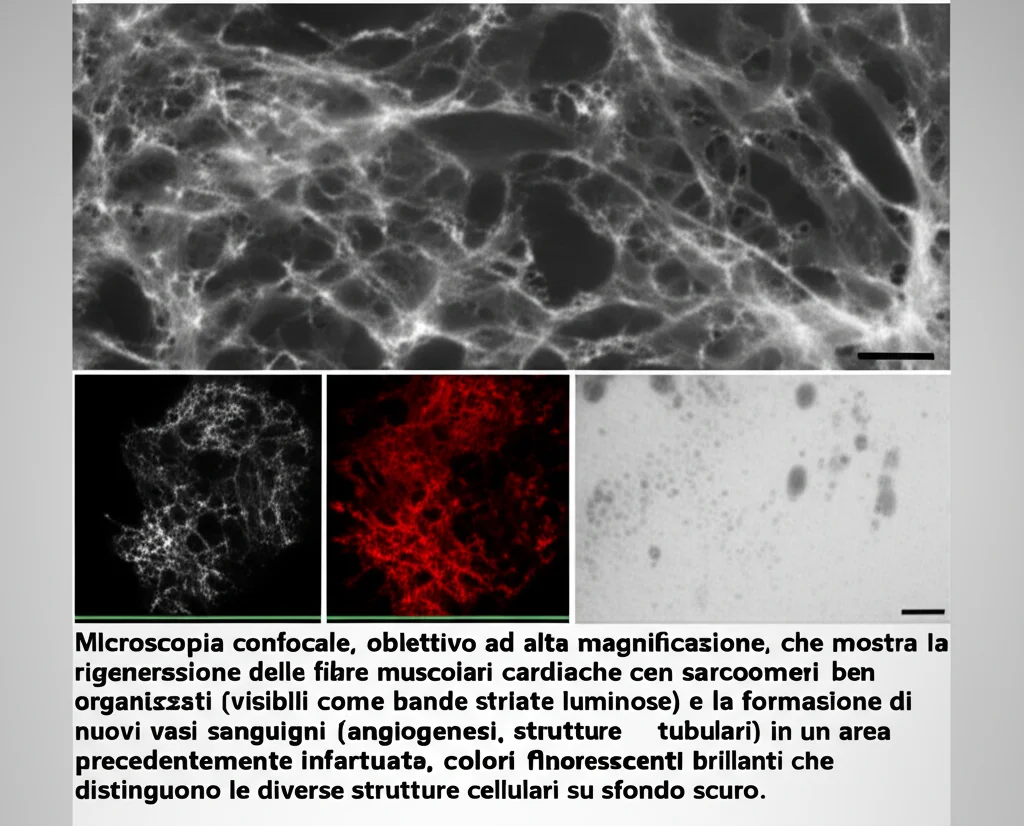
Ma la cosa più entusiasmante è stata vedere, tramite immunofluorescenza, che nei gruppi pASC e cocultura c’era espressione di α-actinina (una proteina fondamentale per la contrazione muscolare). E nel gruppo cocultura, abbiamo addirittura osservato la formazione di strutture sarcometriche, l’organizzazione base delle fibre muscolari cardiache, che erano completamente assenti nel gruppo di controllo! Era come se il tessuto stesse rinascendo!
Geni al Lavoro: La Prova Molecolare della Rigenerazione
Non ci siamo fermati all’osservazione. Siamo andati a curiosare a livello molecolare, analizzando l’espressione di geni chiave. E anche qui, conferme importanti! I marcatori cardiomiogenici, come la troponina T cardiaca (cTnT), la catena pesante della miosina (MHC) e Nkx2.5 (un fattore di trascrizione cruciale per lo sviluppo del cuore), erano significativamente più elevati nei gruppi trattati rispetto ai controlli. Indovinate un po’? Il gruppo cocultura mostrava l’espressione più alta di MHC!
Anche l’espressione di c-Kit, un marcatore di cellule progenitrici, era aumentata in entrambi i gruppi di trattamento, suggerendo che le cellule staminali trapiantate erano attive e potenzialmente si stavano differenziando.
E i geni cattivi, quelli legati all’apoptosi (la morte cellulare programmata)? Marcatori come p21 e Caspase-9 erano più alti nel gruppo di controllo, mentre il gruppo cocultura esibiva la più bassa espressione di p53. Meno morte cellulare, più rigenerazione!
Perché la Cocultura Funziona Meglio? Un Lavoro di Squadra!
Sembra proprio che la combinazione di cellule staminali amniotiche e cardiomiociti sia la strategia vincente. Ma perché?
Le cellule staminali amniotiche hanno potenti effetti immunomodulatori, riducendo l’infiammazione che segue un infarto. Possono trasformare le cellule infiammatorie “cattive” (Th1, Th17, macrofagi M1) in cellule “buone” che promuovono la riparazione (Th2, macrofagi M2). Inoltre, secernono fattori che combattono la fibrosi e regolano la sintesi del collagene.
I cardiomiociti, d’altro canto, possiedono meccanismi di difesa antiossidante intrinseci per mitigare i danni da radicali liberi post-infarto. Esprimono anche Notch1, un regolatore chiave della differenziazione delle cellule progenitrici cardiache, che inibisce l’apoptosi e promuove la neovascolarizzazione. Le cellule endoteliali, presenti nella popolazione cellulare cardiaca primaria che abbiamo usato, secernono neuregulina-1 (NRG-1), un fattore di crescita che migliora la sopravvivenza dei cardiomiociti e promuove la rigenerazione.
In pratica, è come se le due tipologie di cellule lavorassero in sinergia: le staminali creano un ambiente più favorevole alla sopravvivenza e alla rigenerazione, mentre i cardiomiociti forniscono segnali specifici e contribuiscono attivamente al processo di riparazione e alla lotta contro lo stress ossidativo.
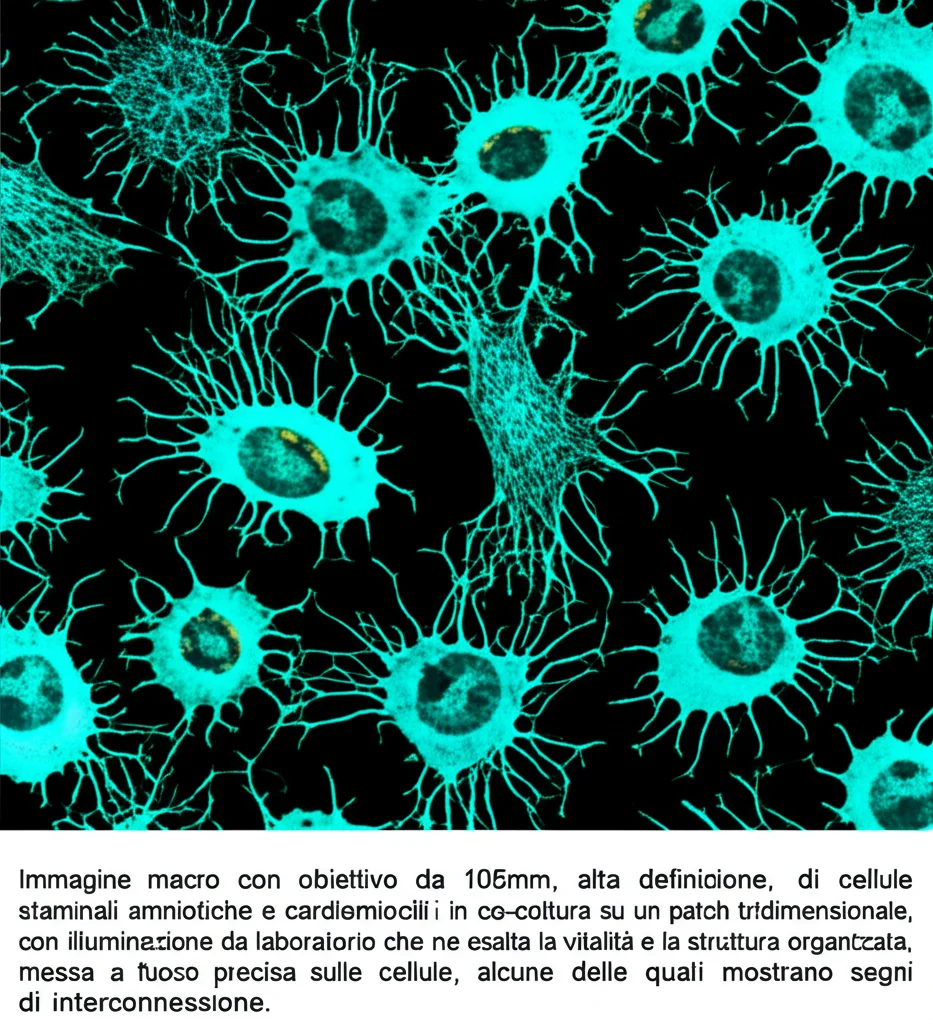
Il patch tridimensionale acellulare non è solo un veicolo passivo. Offre un supporto meccanico alla parete ventricolare infartuata, mitigando l’espansione dell’infarto e prevenendo l’assottigliamento della parete. Inoltre, sottopone le cellule trapiantate a una stimolazione biomeccanica continua, un fattore critico per indirizzare la cardiomiogenesi e promuovere la formazione di tessuto miocardico funzionale. I cardiofibroblasti, posizionati tra le fibre della matrice extracellulare, potrebbero regolare la differenziazione dei miofibroblasti, prevenendo un’eccessiva deposizione di collagene e mantenendo l’omeostasi della matrice.
Angiogenesi: Nuovi Vasi per un Cuore Nuovo
Un altro aspetto cruciale è l’angiogenesi, la formazione di nuovi vasi sanguigni. Un tessuto per rigenerarsi ha bisogno di nutrimento e ossigeno, e questo arriva tramite il sangue. Abbiamo osservato che nel gruppo cocultura la vascolarizzazione era ben distribuita. Le cellule staminali derivate dal tessuto adiposo (simili per certi versi a quelle amniotiche) sono note per migliorare la funzione cardiaca post-infarto secernendo fattori pro-angiogenici come VEGF e TGF-β1. È probabile che anche le nostre pASC abbiano contribuito a questo processo, aiutando a ricostruire la rete vascolare nell’area danneggiata. Nel gruppo di controllo, invece, le aree con fibrosi severa e ipocellularità mostravano una mancanza di vascolarizzazione funzionale.
Uno Sguardo al Futuro della Cardiologia Rigenerativa
Certo, siamo ancora a livello di ricerca preclinica su modelli animali, e ci sono ancora sfide da affrontare, come la necessità di indurre infarti più estesi per testare appieno il potenziale della terapia in condizioni di disfunzione cardiaca significativa. Tuttavia, i risultati sono estremamente promettenti.
Questo studio dimostra chiaramente il potenziale rigenerativo superiore della terapia di cocultura nella riparazione miocardica rispetto al solo trapianto di pASC. I miglioramenti significativi osservati nell’architettura della cicatrice, nel rimodellamento della matrice extracellulare e nella funzione cardiaca nel gruppo cocultura sottolineano il vantaggio terapeutico dell’integrazione di cellule cardiache primarie eterogenee negli interventi basati su cellule staminali.
Questi risultati suggeriscono che le strategie di cocultura possono ottimizzare le interazioni cellulari, migliorare la cardiomiogenesi e il recupero funzionale post-infarto. Immaginate un futuro in cui, dopo un infarto, un “cerotto” personalizzato, coltivato con le vostre stesse cellule o con cellule staminali compatibili, possa essere applicato al vostro cuore per aiutarlo a guarire, a rigenerarsi davvero, riducendo il rischio di insufficienza cardiaca e migliorando la qualità della vita.
Non è fantascienza, è la frontiera della ricerca medica, ed è affascinante farne parte e potervela raccontare! Continueremo a lavorare, a studiare, a sperimentare, perché ogni piccolo passo avanti ci avvicina a trasformare questa speranza in una realtà per milioni di pazienti.
Fonte: Springer