Paclobutrazolo e Castagni: Una Svolta Inaspettata per Nuove Radici!
Amici appassionati di botanica e misteri della natura, oggi vi porto alla scoperta di qualcosa che ha davvero dell’incredibile e che riguarda uno degli alberi più maestosi e utili dei nostri boschi: il castagno! Sapete, la propagazione vegetativa del castagno, cioè la creazione di nuove piante da parti di una pianta madre per conservarne le caratteristiche, è un po’ un osso duro. E il punto cruciale di questa difficoltà è la formazione delle cosiddette radici avventizie, quelle radici che spuntano da parti della pianta che normalmente non le produrrebbero, come fusti o foglie.
Questa difficoltà rappresenta un vero e proprio collo di bottiglia, sia per chi vuole coltivare castagni a livello industriale, sia per noi ricercatori. E qui entra in gioco un protagonista fondamentale: l’auxina. Questo ormone vegetale è coinvolto in praticamente tutti gli aspetti del processo di radicazione avventizia. Pensate che per indurre la formazione di radici nel castagno, è quasi sempre obbligatorio fornire auxina dall’esterno. Però, come in ogni buona storia che si rispetti, ci sono altri attori in campo: altri fitormoni che partecipano agli eventi di segnalazione che portano all’induzione e alla crescita delle radici.
Il Ruolo Nascosto delle Gibberelline
Tra questi ormoni, ci sono le gibberelline (GA). Le gibberelline sono essenziali per un sacco di processi di sviluppo nelle piante, ma quando si tratta di radici avventizie, giocano un po’ a fare le antagoniste: ne inibiscono la formazione. Immaginate la scena: l’auxina che spinge per far crescere nuove radici e le gibberelline che frenano! È un equilibrio delicato.
Nel nostro studio, ci siamo chiesti: cosa succede se interferiamo con questo equilibrio? Abbiamo deciso di investigare il ruolo delle gibberelline e di un loro “nemico”, il paclobutrazolo (PBZ), che è un inibitore della sintesi delle gibberelline. Volevamo capire come questi composti influenzassero la formazione delle radici avventizie nel castagno, usando sia analisi fisiologiche che molecolari.
E qui arriva la parte succosa! Quando abbiamo applicato il paclobutrazolo a microfusti di castagno senza aggiungere auxina dall’esterno, abbiamo osservato la formazione di radici avventizie! Certo, la frequenza era inferiore rispetto al trattamento con la sola auxina, ma il fatto stesso che si formassero era una notizia bomba. Ma non è finita qui. La cosa ancora più interessante è che l’effetto induttivo dell’auxina veniva bloccato se, contemporaneamente, aggiungevamo gibberelline. Un vero e proprio braccio di ferro ormonale!
Il Castagno: Un Patrimonio da Salvare e Valorizzare
Prima di addentrarci nei meccanismi, due parole sul nostro amato Castanea sativa. Non è solo un albero che ci regala castagne deliziose; è una risorsa economica, sociale ed ecologica importantissima, profondamente legata ai paesaggi tradizionali di molte regioni, come la Galizia nel nord-ovest della Spagna. Purtroppo, i cambiamenti climatici mettono a rischio le popolazioni di castagno, e sfruttare al meglio la diversità genetica disponibile potrebbe essere una strategia adattativa a lungo termine fondamentale. Le varietà commerciali di castagno sono spesso innestate su portainnesti interspecifici (come C. sativa × C. crenata o C. sativa × C. mollissima) per conferire resistenza a patogeni comuni come la Phytophthora cinnamomi o la Cryphonectria parasitica. L’innesto può anche aiutare a superare problemi di auto-sterilità.
Tuttavia, la propagazione vegetativa tradizionale per innesto è costosa e richiede tempo, e la resistenza fornita dai portainnesti ibridi può non essere completa. In generale, i protocolli di propagazione vegetativa per il castagno hanno bassi tassi di successo e dipendono molto dal genotipo. Ecco perché è così desiderabile ottimizzare questi protocolli, specialmente per varietà di C. sativa preziose per la produzione di legname e frutti, geneticamente tolleranti alle minacce biologiche e resilienti agli stress indotti dal cambiamento climatico.
La radicazione avventizia (AR) è il metodo più appropriato per la propagazione vegetativa di talee di alberi recalcitranti, permettendo di preservare genotipi importanti e massimizzare la produttività. Questo processo si divide in fasi: induzione, iniziazione ed espressione, anche se in molte specie, castagno incluso, è necessario un passo iniziale di de-differenziazione. In questa fase preliminare, i programmi di espressione genica in corso vengono disattivati, portando cellule specifiche a uno stato responsivo, pronte a innescare un nuovo programma di sviluppo in presenza degli stimoli induttivi appropriati.
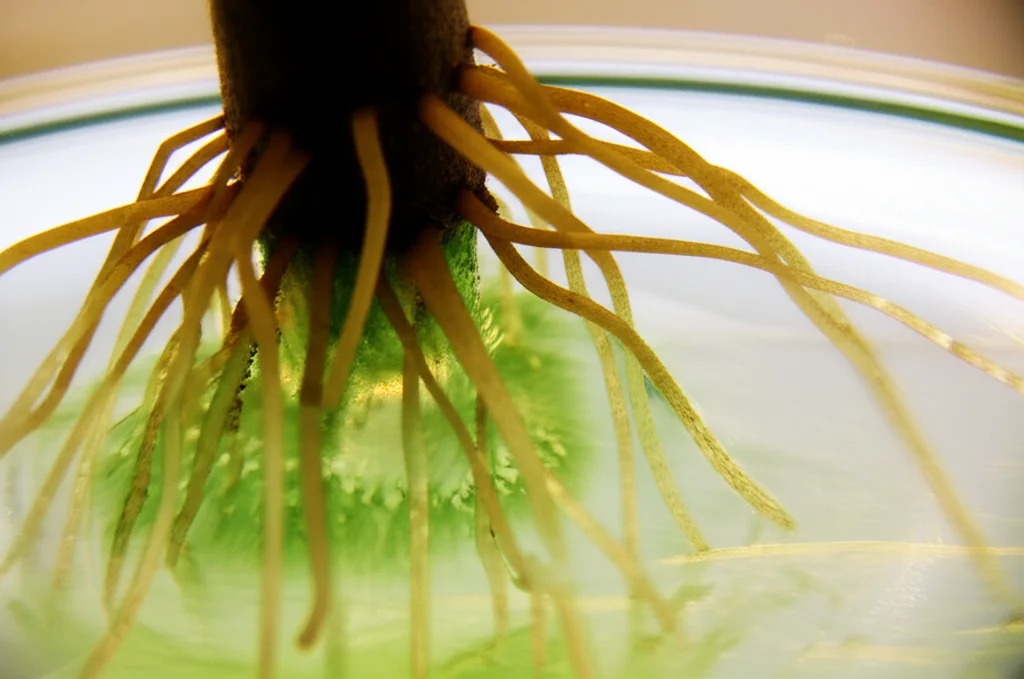
Il successo di questo processo dipende principalmente dall’attività dell’auxina. Il suo accumulo asimmetrico in cellule specifiche dei fasci vascolari o dei tessuti circostanti durante la fase di induzione determina la formazione di cellule fondatrici della radice negli steli delle talee e dei microfusti, che alla fine si svilupperanno nella nuova radice. Questo accumulo di auxina è una conseguenza dell’attività di diverse proteine trasportatrici di auxina, che innescano specifiche cascate di segnali nelle cellule dove l’auxina si concentra. Anche altri ormoni possono influenzare l’induzione e lo sviluppo delle radici avventizie, tra cui etilene, jasmonati, citochinine, acido abscissico o gibberelline, sebbene il loro ruolo preciso non sia ben definito e possa essere specie-specifico.
L’Esperimento nel Dettaglio: Come Abbiamo Fatto?
Per i nostri esperimenti, abbiamo utilizzato microfusti “giovanili” di castagno, ottenuti da germogli basali di un albero di 80 anni e mantenuti in vitro per oltre 30 anni. Questi microfusti sono stati coltivati su un terreno di coltura specifico e poi trasferiti su un terreno di radicazione basale, a cui abbiamo aggiunto diverse combinazioni di ormoni.
Abbiamo testato diverse concentrazioni di acido gibberellico (GA3) e paclobutrazolo (PBZ) in combinazione con auxina (acido indol-butirrico, IBA). Per capire l’effetto delle gibberelline endogene, abbiamo aggiunto PBZ da solo. Abbiamo anche aggiunto GA3 da solo per verificarne l’effetto sulla performance dei microfusti. E per non farci mancare nulla, abbiamo testato l’effetto dell’acido naftil-ftalamico (NPA), un inibitore del trasporto polare dell’auxina, sia con PBZ che con IBA.
I risultati sono stati chiari:
- L’auxina da sola (IBA 2.5 µM) ha indotto un tasso di radicazione del 90%. Un classico!
- Quando IBA e GA3 sono stati applicati insieme, fino a 20 µM di GA3 non hanno influenzato significativamente il tasso di radicazione, ma il numero di radici tendeva a diminuire. Tuttavia, a 40 µM, le GA hanno bloccato l’induzione delle radici avventizie, con un crollo del tasso di radicazione al 6.5% e una riduzione drastica del numero di radici.
- Il PBZ, quando applicato insieme all’IBA, non ha avuto effetti significativi sul tasso di radicazione (che è rimasto tra il 90 e il 95%), ma ha fatto aumentare costantemente il numero di radici all’aumentare della sua concentrazione.
- E la sorpresa più grande: quando il PBZ è stato applicato da solo (a 40 µM), il 40% dei microfusti ha radicato, sebbene il numero di radici fosse basso. Questo ci dice che bloccare la biosintesi delle GA induce la radicazione nel castagno, anche se meno efficacemente dell’IBA esogeno.
- L’NPA, l’inibitore del trasporto dell’auxina, ha ridotto il tasso di radicazione allo 0% quando combinato con IBA, e lo stesso è successo quando combinato con PBZ. Questo suggerisce che bloccare il trasporto polare dell’auxina impedisce l’effetto induttivo del PBZ.
Interessante anche notare che il trattamento con GA3 tendeva ad aumentare la lunghezza delle radici in modo dose-dipendente, mentre in presenza di PBZ la lunghezza diminuiva, soprattutto alla concentrazione più alta.
Dentro la Cellula: Cosa Succede a Livello Molecolare?
Per capire meglio i processi molecolari dietro queste risposte, abbiamo fatto un’analisi trascrittomica, cioè abbiamo guardato quali geni venivano “accesi” o “spenti” nei diversi trattamenti. Abbiamo confrontato campioni trattati con GA, IBA+GA e PBZ con campioni di controllo non trattati.
I risultati hanno mostrato che gli effetti dei trattamenti erano più rilevanti del tempo trascorso dall’inizio dell’esperimento. Abbiamo identificato un gran numero di geni differenzialmente espressi (DEG). In particolare, 94 DEG erano unici per il trattamento con PBZ, e potrebbero fornirci informazioni cruciali sui percorsi di induzione radicale attivati da questo bloccante della sintesi delle GA. D’altra parte, oltre 600 DEG erano esclusivi del trattamento IBA+GA, e potrebbero aiutarci a capire i meccanismi molecolari con cui le GA bloccano l’effetto dell’auxina sulla radicazione avventizia.

Tra i geni interessanti nei campioni trattati con PBZ, abbiamo trovato fattori di trascrizione della famiglia NAC e il fattore di trascrizione responsivo all’etilene CsWIND-1, coinvolto nei processi di riparazione tissutale, che potrebbe essere correlato alla capacità di questi microfusti di formare radici. Nei campioni IBA+GA, invece, spiccavano fattori di trascrizione delle famiglie WRKY e AP2 (correlata all’etilene).
Un risultato chiave è stato l’effetto sul gene CsPIN1, un trasportatore di auxina. Studi precedenti avevano già collegato l’espressione di CsPIN1 a un miglioramento della capacità di radicazione dei microfusti maturi di castagno. Ebbene, nel nostro studio, il PBZ ha indotto significativamente l’espressione di CsPIN1. Al contrario, quando i campioni sono stati trattati con auxina e GA, il gene ha mostrato un calo significativo della sua espressione. Sembra quindi che CsPIN1 sia sotto il controllo delle GA, che ne bloccano l’attività specifica nella radicazione avventizia.
Un altro gene, CsLBD16, che codifica per un fattore di trascrizione della famiglia LOB ed è noto per essere responsivo all’auxina e un marcatore per le cellule primordiali della radice, è risultato indotto da entrambi i trattamenti (PBZ e IBA+GA) nelle prime 48 ore. Questo suggerisce che CsLBD16 potrebbe essere un marcatore di rigenerazione in senso ampio, non specifico solo per lo sviluppo radicale nelle primissime fasi.
Inoltre, l’analisi trascrittomica ha rivelato l’induzione del recettore delle GA, CsGID1b, dopo il trattamento con PBZ. Questo è stato confermato con analisi qRT-PCR. Il blocco della sintesi delle GA sembra quindi indurre un aumento del recettore delle GA, forse come meccanismo di feedback per mantenere attivo il segnale delle GA. Tuttavia, l’espressione di CsGID2, un’altra proteina coinvolta nella via di segnalazione canonica delle GA, non è stata influenzata, suggerendo una possibile via di segnalazione alternativa indipendente dall’attività delle proteine DELLA, che sono i repressori canonici della via delle GA.
Conclusioni e Prospettive Future: Un Puzzle Complesso
Quindi, cosa ci dice tutto questo? Abbiamo scoperto che il paclobutrazolo (PBZ) innesca la formazione di radici avventizie nel castagno, almeno in parte, attraverso la sua capacità di modulare il trasporto e la segnalazione dell’auxina, come dimostrato dall’espressione di CsPIN1 e CsLBD16. Le gibberelline (GA), d’altro canto, inibiscono la radicazione avventizie in questa specie, e questo è stato confermato quando auxine e GA sono state applicate insieme.
L’induzione del recettore delle GA, CsGID1b, in risposta all’inibizione della sintesi endogena di GA suggerisce l’esistenza di un meccanismo per controbilanciare la diminuzione di questo ormone. Resta da capire se l’induzione radicale da parte del PBZ si basi sull’attività di geni regolati dalle GA che non sono sotto il controllo delle proteine DELLA – una domanda che richiederà ulteriori ricerche.
Apparentemente, l’attività di componenti di altre vie di segnalazione dei fitormoni, in momenti specifici, potrebbe contribuire all’effetto bloccante delle GA sulla radicazione avventizia. Ad esempio, le vie di segnalazione dell’etilene e dell’acido abscissico sono state attivate in risposta al trattamento IBA+GA, suggerendo un loro possibile coinvolgimento nell’effetto negativo delle GA.
Questi risultati ci aiutano a comprendere meglio la natura genetica della recalcitranza nel castagno e forniscono nuove intuizioni sul ruolo delle GA nella radicazione e sulle loro interazioni con l’auxina. Queste informazioni saranno preziose per lo sviluppo di protocolli di propagazione vegetativa ottimizzati per questa specie così importante, aiutandoci a preservare la sua diversità genetica e a renderla più resiliente alle sfide del futuro.
Insomma, un piccolo passo per un microfusto, ma un grande passo per la castanicoltura e la ricerca botanica! Continueremo a scavare (letteralmente e metaforicamente) per svelare tutti i segreti di questi affascinanti processi.
Fonte: Springer







