P-caderina: La Chiave Nascosta nell’Aggressività del Tumore Ovarico?
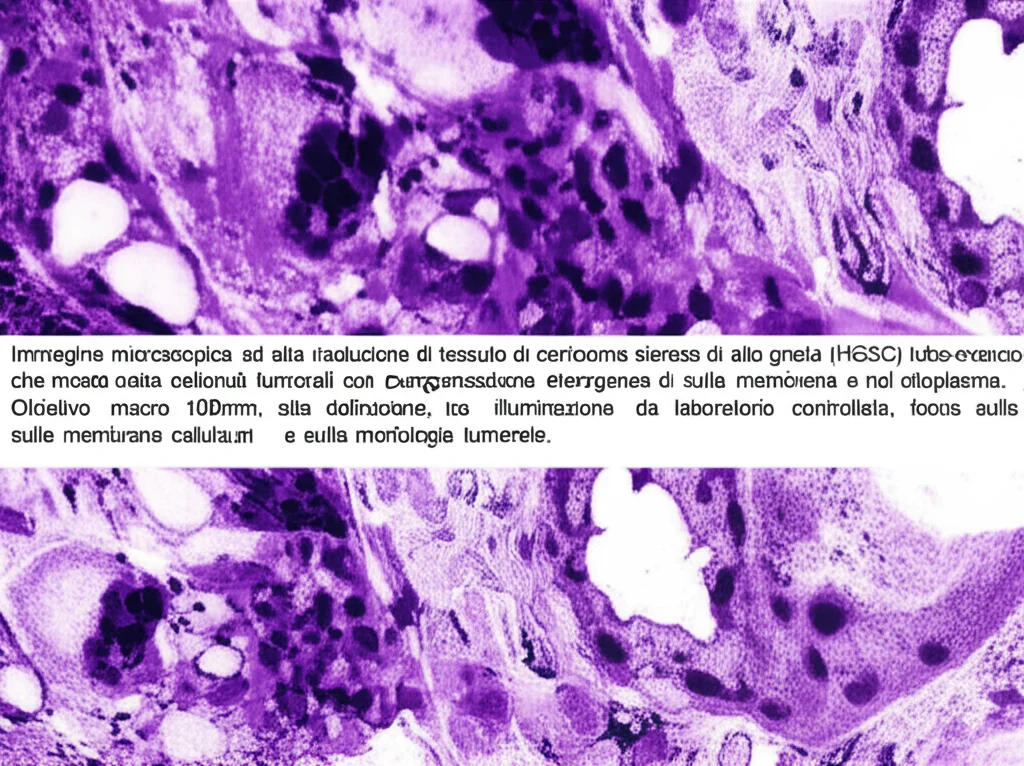
Ciao a tutti! Oggi voglio portarvi con me in un viaggio affascinante nel mondo della ricerca oncologica, un campo dove ogni scoperta può accendere una nuova speranza. Parleremo di un nemico subdolo, il carcinoma sieroso di alto grado tubo-ovarico (HGSC), la forma più comune e purtroppo più letale di tumore ovarico. Spesso, quando viene diagnosticato, è già in fase avanzata, con metastasi sparse nel peritoneo e la presenza di liquido ascitico, rendendo la prognosi piuttosto cupa.
Una delle sfide più grandi con l’HGSC è che circa la metà dei casi mostra una “competenza” nella riparazione del DNA tramite ricombinazione omologa (li chiamiamo HRP, Homologous Recombination Proficient). Sembra una buona cosa, vero? In realtà, questi tumori sono spesso resistenti alla chemioterapia a base di platino e hanno una prognosi peggiore. Capire cosa li rende così aggressivi è fondamentale, ed è qui che entra in gioco la nostra indagine.
Plasticità Cellulare: Un Camaleonte nel Tumore
Avete mai sentito parlare di plasticità epitelio-mesenchimale (EMP)? Immaginate le cellule tumorali come dei trasformisti. Normalmente, le cellule epiteliali sono ben “educate”, stanno al loro posto, legate strettamente le une alle altre. Le cellule mesenchimali, invece, sono più “nomadi”, capaci di muoversi e invadere. L’EMP è un processo che permette alle cellule di acquisire caratteristiche di entrambi i tipi, diventando ibride (fenotipi E/M ibridi). Questa capacità di cambiare forma e comportamento sembra essere cruciale per la diffusione del tumore. Pensate a cellule che possono staccarsi dal tumore principale (un tratto mesenchimale) ma viaggiare in gruppo e resistere alla morte cellulare programmata (anoikis) quando sono “senza radici” (tratti epiteliali/ibridi).
È interessante notare che già nelle lesioni precancerose trovate nelle tube di Falloppio (le cosiddette STICs, considerate le precursori dell’HGSC), si vedono segni che suggeriscono l’attivazione dell’EMP: perdita di polarità, piccole fratture nel tessuto, cellule che si staccano. Questo ci ha fatto chiedere: questa capacità di trasformazione contribuisce all’inizio e alla diffusione dell’HGSC? Potrebbe essere un nuovo biomarker?
Le Caderine Sotto la Lente: E, N e la “Nuova” P
Per capirlo, abbiamo deciso di studiare delle molecole chiamate caderine. Sono come la “colla” che tiene unite le cellule. Le più note sono:
- E-caderina: tipica delle cellule epiteliali “ben educate”.
- N-caderina: spesso associata alle cellule mesenchimali “nomadi”.
- P-caderina: una candidata interessante come marcatore di questi stati ibridi E/M.
Abbiamo analizzato l’espressione di queste tre caderine in centinaia di campioni umani, rappresentando tutte le fasi della possibile progressione del cancro sieroso, partendo dall’epitelio normale delle tube di Falloppio (FTE) fino ai tumori avanzati e alle metastasi. Abbiamo usato la patologia digitale, che ci permette analisi molto precise.

Una Sorpresa: Lo Switch N-P e il Ruolo Precoce della P-caderina
E qui arriva la sorpresa! Ci aspettavamo forse il classico “switch E-N”, dove la E-caderina diminuisce e la N-caderina aumenta man mano che il tumore diventa più aggressivo. Invece, abbiamo osservato uno “switch N-P” non canonico. Cosa significa?
L’espressione di N-caderina, che è normalmente presente nell’epitelio sano delle tube (quindi qui funge da marcatore “epiteliale”, contrariamente al suo ruolo classico!), diminuiva nei tumori. La E-caderina rimaneva generalmente molto alta in quasi tutti gli stadi. Ma la vera protagonista è stata la P-caderina: la sua espressione aumentava significativamente già nelle lesioni pre-maligne (come le STICs e persino le “firme p53”, considerate i primissimi segnali di allarme) rispetto all’epitelio normale. Era come se la P-caderina si “accendesse” molto presto nel processo di trasformazione maligna.
Questo aumento era ancora più marcato nelle cellule tumorali trovate nel liquido ascitico, quel fluido che si accumula nell’addome nei casi avanzati e che è un veicolo per la diffusione metastatica. Sembra quasi che la P-caderina aiuti le cellule a staccarsi, sopravvivere “galleggiando” e poi magari attaccarsi da qualche altra parte, come il peritoneo.
P-caderina Alta, Prognosi Peggiore (Soprattutto in un Sottogruppo)
Abbiamo poi controllato se ci fosse un legame tra l’espressione di queste caderine e la sopravvivenza delle pazienti. Ebbene sì: un’alta espressione di P-caderina nei tumori era associata significativamente a una sopravvivenza globale peggiore. Questo legame era particolarmente forte nel sottogruppo di tumori senza mutazioni nei geni BRCA1/2 (e più in generale, nei tumori HRP, quelli resistenti al platino e con prognosi infausta). Sembra proprio che la P-caderina sia un indicatore di aggressività in questo specifico gruppo di pazienti per cui abbiamo un disperato bisogno di nuovi bersagli terapeutici.

Conferme dal Laboratorio: Silenziare la P-caderina Rallenta le Cellule
Per essere sicuri che non fosse solo una coincidenza, siamo passati al laboratorio. Abbiamo preso delle linee cellulari di HGSC rappresentative del tipo HRP e resistenti al platino, che esprimevano alti livelli di P-caderina. Usando una tecnica chiamata silenziamento genico (con siRNA), abbiamo “spento” temporaneamente il gene che produce la P-caderina (il gene CDH3).
I risultati sono stati illuminanti! Le cellule con meno P-caderina mostravano:
- Una ridotta resistenza all’anoikis (morivano più facilmente quando staccate dal supporto).
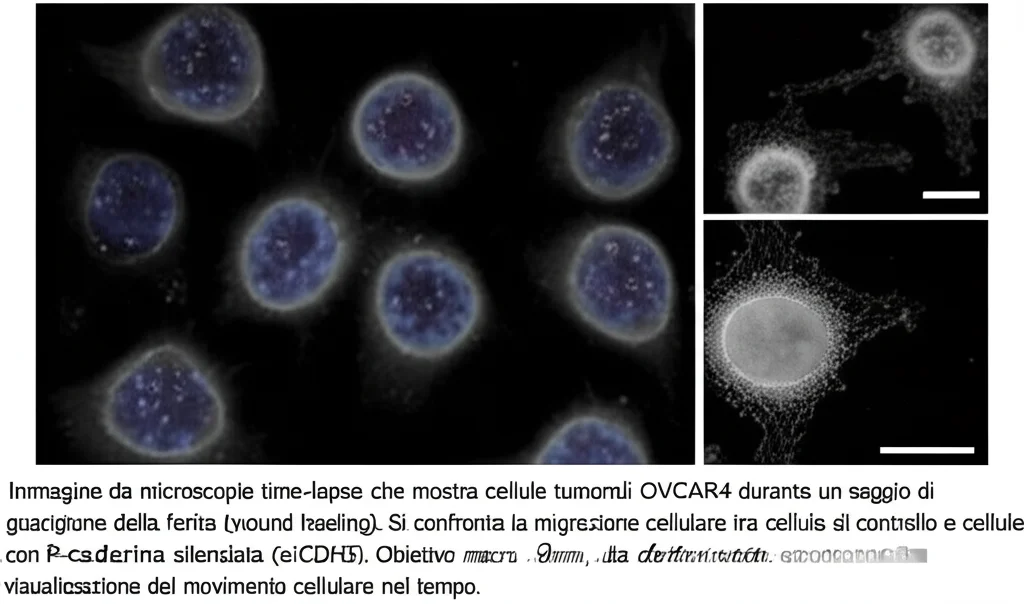
- Una minore capacità di migrazione collettiva (facevano più fatica a muoversi insieme per “chiudere una ferita” in una piastra di coltura).
- Una ridotta capacità di invasione (penetravano meno in una matrice che simulava il tessuto circostante).
Queste sono tutte caratteristiche funzionali associate a un fenotipo ibrido E/M e a un comportamento più aggressivo. Spegnere la P-caderina sembrava rendere le cellule meno “cattive”. Abbiamo fatto test simili anche su un’altra linea cellulare (BG1, probabilmente un carcinoma endometrioide ovarico, non sieroso) e anche lì, meno P-caderina significava meno migrazione e invasione, suggerendo che il ruolo di questa molecola potrebbe estendersi anche ad altri tipi di tumore ovarico aggressivo.
Cosa Ci Dice Tutto Questo? Un Nuovo Indiziato per l’Aggressività HRP
Mettendo insieme tutti i pezzi, i nostri risultati suggeriscono fortemente che l’overespressione di P-caderina sia un evento precoce nella carcinogenesi sierosa e possa essere coinvolta nell’attivazione di quei fenotipi ibridi E/M che rendono i tumori HRP così difficili da trattare. L’insolito switch N-P, con la P-caderina che prende il posto della N-caderina mentre la E-caderina rimane alta, potrebbe essere la firma molecolare di questa plasticità pericolosa.
La P-caderina potrebbe aiutare le cellule trasformate a staccarsi dalla tuba di Falloppio (acquisendo tratti mesenchimali), ma allo stesso tempo permettere loro di sopravvivere in sospensione nel fluido peritoneale formando aggregati coesi (mantenendo tratti epiteliali grazie alla P-caderina stessa e alla E-caderina), pronti a colonizzare nuovi siti come l’ovaio e il peritoneo.
Verso il Futuro: P-caderina Come Biomarker e Bersaglio?
Ovviamente, la ricerca non si ferma qui. Serviranno studi più ampi, prospettici e magari con tecniche avanzate come il tracciamento del lignaggio cellulare *in vivo* per confermare questi risultati e capire ancora meglio le dinamiche dell’EMP. Ma quello che emerge è che la P-caderina si candida come un promettente biomarker per identificare quel sottogruppo di pazienti con HGSC-HRP a prognosi peggiore e, chissà, forse in futuro potrebbe diventare anche un nuovo bersaglio terapeutico.
È un piccolo passo, ma nella lotta contro il cancro ovarico, ogni passo conta. E continuare a indagare su molecole come la P-caderina ci avvicina a comprendere meglio il nemico e, speriamo, a trovare nuovi modi per sconfiggerlo.
Fonte: Springer