Osteoclasti e Infiammazione: Un Ballo Pericoloso tra Crescita e Distruzione
Amici appassionati di scienza e curiosi del corpo umano, benvenuti! Oggi voglio portarvi con me in un viaggio affascinante nel microscopico mondo delle nostre ossa, un mondo dove equilibrio è la parola d’ordine, ma dove a volte gli equilibri si spezzano. Parleremo di osteoclasti, le cellule “spazzine” del nostro osso, e di come un ambiente infiammatorio, in particolare quello creato dai macrofagi M1, possa mandare tutto all’aria. Pronti a scoprire come l’infiammazione gioca un ruolo da protagonista, a volte benefico, a volte nefasto, nella vita di queste cellule fondamentali?
L’eterno dilemma: l’infiammazione fa bene o male alle nostre ossa?
Da tempo sappiamo che l’infiammazione cronica non è esattamente una passeggiata di salute per il nostro scheletro. Pensate a malattie come l’artrite reumatoide, la parodontite o i problemi che possono sorgere attorno alle protesi: spesso c’è di mezzo lei, l’infiammazione, che tende a favorire la perdita di osso e a limitare la sua rigenerazione. Ma come esattamente? E soprattutto, l’effetto è sempre e solo negativo? Beh, la risposta, come spesso accade in biologia, è “dipende”.
Si è discusso a lungo se gli stimoli infiammatori, specialmente quelli derivanti dai macrofagi M1 (i nostri “soldati” dell’immunità che entrano in gioco nelle fasi acute dell’infiammazione), spingano verso la formazione di più osteoclasti – e quindi più riassorbimento osseo – oppure se, al contrario, mettano loro i bastoni tra le ruote. E non è tutto: come questo ambiente turbolento influenzi la capacità dei precursori degli osteoclasti di moltiplicarsi o, ahimè, di andare incontro a morte programmata (apoptosi) durante la loro “maturazione”, era un altro bel rompicapo.
Entriamo in laboratorio: come abbiamo simulato un campo di battaglia infiammatorio
Per capirci qualcosa di più, nel nostro studio ci siamo rimboccati le maniche. Abbiamo preso delle cellule chiamate RAW264.7, una linea cellulare di macrofagi murini che, se stimolate con una molecola chiave chiamata RANKL, si trasformano in osteoclasti. È un po’ come dare a dei soldati semplici l’ordine di specializzarsi in demolizioni.
Per mimare l’ambiente infiammatorio, abbiamo fatto una cosa furba: abbiamo coltivato dei macrofagi derivati dal midollo osseo (BMDM) e li abbiamo “arrabbiati” con del lipopolisaccaride (LPS), una componente della parete dei batteri che scatena una forte risposta infiammatoria, trasformandoli di fatto in macrofagi M1. Poi abbiamo raccolto il “brodo di coltura” di questi macrofagi M1, pieno zeppo di mediatori infiammatori (citochine, chemochine), e lo abbiamo chiamato “mezzo condizionato”. Questo cocktail infiammatorio è stato poi aggiunto alle nostre cellule RAW264.7 mentre le inducevamo a diventare osteoclasti con RANKL. Volevamo vedere, insomma, come se la cavassero i futuri osteoclasti in un ambiente così “ostile”.
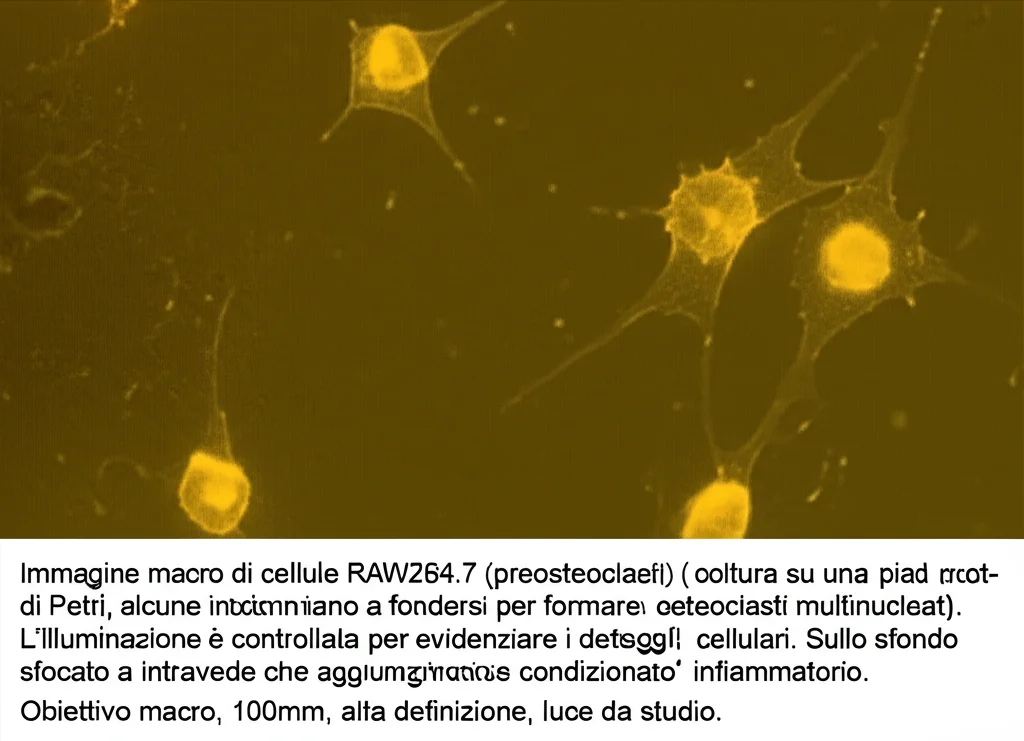
La sorpresa: un doppio gioco nel destino dei preosteoclasti
E qui, signore e signori, arriva la parte interessante, quasi un colpo di scena! L’aggiunta di questo “succo” infiammatorio ha provocato un cambiamento bifasico nel numero di cellule. Cosa significa? Che all’inizio, nelle prime 48 ore, i preosteoclasti (le cellule che si stanno differenziando in osteoclasti) hanno ricevuto una sorta di spinta a proliferare, a moltiplicarsi. Il loro numero è aumentato! Abbiamo visto che vie di segnalazione legate alla proliferazione, come AKT e ERK, si attivavano temporaneamente. Anche l’espressione di c-myc, un importante fattore di trascrizione per la differenziazione degli osteoclasti, e di geni pro-infiammatori come Tnf-a e Nos2, aumentava. Sembrava quasi che l’infiammazione dicesse: “Forza ragazzi, datevi da fare!”.
Ma la festa non è durata a lungo. Dal quarto giorno in poi, la situazione si è ribaltata. Il numero di cellule ha iniziato a calare drasticamente. Sembrava che un’esposizione prolungata a quell’ambiente infuocato non facesse per niente bene ai nostri aspiranti osteoclasti. Anzi, quelli che non si erano ancora differenziati andavano incontro ad apoptosi, la morte cellulare programmata. Un po’ come dire: “Ok, l’emergenza iniziale è passata, ma se l’allarme continua a suonare troppo a lungo, qui si muore”.
Sotto la lente: cosa succede a livello molecolare?
Scavando un po’ più a fondo, abbiamo cercato di capire i meccanismi. L’attivazione transitoria di AKT e ERK, come dicevo, è cruciale. AKT, in particolare, è rimasto attivo più a lungo, per almeno 48 ore, e questo si correlava bene con l’aumento di c-myc. ERK, invece, si attivava in modo più fugace. Curiosamente, l’espressione di c-fos, un altro attore importante, non cambiava, e quella di Nfatc1 (il “capo orchestra” della differenziazione osteoclastica) addirittura diminuiva inizialmente per poi tornare normale. Questo suggerisce che forse la persistenza dell’attivazione di ERK è fondamentale per spingere su c-fos e Nfatc1 in modo efficace.
Anche la via di NF-κB, un classico sentiero infiammatorio coinvolto anche nella formazione degli osteoclasti, si accendeva temporaneamente, così come l’espressione dei geni pro-infiammatori Tnf-a e Nos2. Questo ci dice che i preosteoclasti “sentono” l’ambiente infiammatorio e rispondono accendendo i loro stessi segnali di infiammazione.
Non è solo una questione di singoli attori: il concerto delle citochine
Una cosa che questa ricerca sottolinea è la complessità dell’ambiente infiammatorio. Non è come testare l’effetto di una singola citochina. Per esempio, noi sappiamo che l’interleuchina-6 (IL-6), una citochina pro-infiammatoria, può promuovere la proliferazione cellulare. E infatti, trattando i preosteoclasti solo con IL-6, abbiamo visto un aumento transitorio della vitalità cellulare, simile a quello iniziale osservato con il mezzo condizionato. Al contrario, un’altra citochina, l’interferone-gamma (IFN-γ), riduceva la vitalità cellulare fin da subito.
Il nostro “mezzo condizionato” era un vero e proprio cocktail: conteneva alti livelli di IL-6, TNF-α, IL-1β, varie chemochine (CCL2, CCL3, CCL5, CXCL10) e persino alcune citochine considerate tipiche dei macrofagi M2 (quelli più “riparatori”). Questo mix complesso spiega perché l’effetto finale non è prevedibile guardando solo ai singoli componenti. È l’insieme che conta, un vero e proprio “concerto” di segnali con effetti positivi e negativi che si bilanciano o si sbilanciano a seconda della durata dell’esposizione.
E la capacità di “mangiare” l’osso? Un’occhiata ai geni della distruzione
Ma veniamo al sodo: questi preosteoclasti, sotto l’effetto dell’infiammazione, diventano più “cattivi”, cioè più capaci di riassorbire osso? Abbiamo guardato l’espressione di geni chiave per il riassorbimento osseo, come la Catepsina K (Ctsk), la fosfatasi acida tartrato-resistente (Trap) e la metalloproteinasi-9 (Mmp9).
Dopo tre ore di esposizione all’ambiente infiammatorio, l’espressione di tutti e tre questi geni aumentava! Sembrava che l’infiammazione desse una spinta iniziale anche alla loro capacità “distruttiva”. Tuttavia, anche qui, l’effetto non era duraturo. Dopo 24 ore di esposizione, l’aumento non era più così marcato, e per Trap l’espressione era addirittura inferiore rispetto ai controlli. Solo Mmp9 manteneva una tendenza all’aumento. Quindi, anche la funzione riassorbitiva sembra essere potenziata solo transitoriamente.
Il triste epilogo: l’infiammazione cronica porta alla morte cellulare
Come abbiamo visto, l’esposizione prolungata all’ambiente infiammatorio riduceva il numero di cellule. Per confermare che si trattasse di apoptosi, abbiamo misurato l’espressione di geni pro-apoptotici come Bad e Bax. Ebbene, dopo 4 giorni di esposizione al “succo” infiammatorio, l’espressione di questi geni era aumentata, confermando che l’infiammazione cronica, almeno in questo contesto, spinge i preosteoclasti verso la morte. Questo potrebbe essere un meccanismo protettivo per evitare un eccessivo riassorbimento osseo in condizioni di infiammazione persistente, ma potrebbe anche contribuire alla perdita di massa ossea se troppe cellule “buone” vengono eliminate.
Cosa ci portiamo a casa da questa ricerca?
Quindi, cosa ci dice tutto questo? Che l’interazione tra infiammazione e osteoclastogenesi è una faccenda dannatamente complessa e dinamica! Un’esposizione infiammatoria a breve termine, come quella che potrebbe verificarsi all’inizio di un’infezione o di un trauma, sembra promuovere transitoriamente la proliferazione dei precursori degli osteoclasti e la loro differenziazione, forse per accelerare il rimodellamento osseo necessario. Tuttavia, se l’infiammazione persiste, come nelle malattie croniche, l’effetto si inverte, portando alla morte cellulare e potenzialmente alterando l’equilibrio del nostro tessuto osseo.
Questi risultati aprono nuove prospettive per capire meglio malattie come l’osteoporosi o l’artrite reumatoide, dove l’infiammazione gioca un ruolo chiave. Comprendere come modulare questa risposta bifasica potrebbe, in futuro, aiutarci a sviluppare terapie più mirate per proteggere le nostre ossa quando sono sotto l’attacco dell’infiammazione. Insomma, la ricerca continua, e ogni piccolo tassello ci aiuta a comporre un puzzle sempre più chiaro della meravigliosa complessità del nostro organismo!
Fonte: Springer