Come ho potenziato l’Ossido di Manganese con lo Zinco: Superpoteri Nascosti!
Ciao a tutti! Oggi voglio raccontarvi di un’avventura scientifica davvero affascinante in cui mi sono tuffato di recente. Avete presente l’ossido di manganese (Mn2O3)? È un materiale con delle potenzialità incredibili, ma come spesso accade in scienza, c’è sempre margine per migliorare. Il mio obiettivo? Trasformare queste nanoparticelle in veri e propri campioni di efficienza, sia come fotocatalizzatori che come agenti antibatterici. E come ho pensato di farlo? Con un pizzico di… zinco!
Perché l’Ossido di Manganese e perché lo Zinco?
Partiamo dalle basi. Viviamo in un mondo dove l’inquinamento idrico, specialmente quello causato dai coloranti organici industriali (tessile, carta, farmaceutica), è un problema serio. Queste sostanze non solo rendono l’acqua torbida e colorata, limitando la fotosintesi per la vita acquatica, ma possono anche essere dannose per noi umani. Parallelamente, le infezioni batteriche sono un’altra grande minaccia per la salute globale. Serve una soluzione, e qui entra in gioco la fotocatalisi.
La fotocatalisi è un processo che usa la luce (preferibilmente quella solare, economica e abbondante!) per attivare un materiale (il fotocatalizzatore) che a sua volta genera specie chimiche molto reattive, capaci di distruggere inquinanti e batteri, trasformandoli in sottoprodotti innocui come acqua e CO2. È una tecnologia pulita, sostenibile e potenzialmente molto economica.
L’ossido di manganese (Mn2O3) è un candidato interessante: è un semiconduttore di tipo p, non tossico, economico e amico dell’ambiente. Tuttavia, la sua efficienza sotto la luce visibile può essere migliorata. Qui entra in scena lo zinco (Zn). L’idea è quella del “drogaggio”: inserire atomi di zinco nella struttura cristallina del Mn2O3. Perché proprio lo zinco? Beh, gli ioni zinco (Zn2+) hanno dimensioni simili a quelli del manganese (Mn3+), il che facilita la loro integrazione nella struttura ospite senza stravolgerla troppo. Inoltre, lo zinco, o meglio l’ossido di zinco (ZnO), è già noto per le sue proprietà fotocatalitiche e antibatteriche, anche se ha i suoi limiti (funziona meglio con la luce UV). La mia scommessa era: e se combinassimo le potenzialità dei due? Se drogando il Mn2O3 con lo zinco riuscissimo a migliorarne l’assorbimento della luce visibile e, magari, potenziare anche l’effetto antibatterico? Pochi studi si erano concentrati su questa specifica combinazione (Zn che droga Mn2O3), quindi c’era terreno fertile da esplorare!
La Ricetta: Creare le Nanoparticelle “Potenziate”
Mettersi ai fornelli… ehm, in laboratorio! Ho usato un metodo chiamato “precipitazione”, abbastanza semplice ed efficace. In pratica, ho sciolto sali di manganese in acqua e poi, goccia a goccia, ho aggiunto una base (NaOH) per far precipitare l’ossido di manganese sotto forma di solido. Per creare le versioni drogate, ho semplicemente aggiunto diverse quantità di un sale di zinco (acetato di zinco) alla soluzione iniziale di manganese, ottenendo campioni con il 3%, 5% e 10% di zinco rispetto al manganese totale. Dopo aver raccolto il precipitato, l’ho lavato, asciugato e “cotto” (calcinato) a 500°C per ottenere le nanoparticelle finali.
Cosa abbiamo scoperto? Analisi ai Raggi X (e non solo!)
Una volta pronte le polveri (Mn2O3 puro e le versioni drogate con Zn), è arrivato il momento di capire cosa avevamo creato.
- Struttura Cristallina (XRD): Usando i raggi X, abbiamo visto che il Mn2O3 puro ha una struttura cubica. Ma, sorpresa! Appena abbiamo aggiunto lo zinco, la struttura è cambiata, trasformandosi in una tetragonale, tipica del composto ZnMn2O4. Questo ci ha confermato che lo zinco non si era solo mescolato, ma era entrato a far parte della struttura cristallina! Inoltre, abbiamo notato che più zinco aggiungevamo, più piccoli diventavano i cristalliti (da 15 nm nel Mn2O3 puro a soli 9 nm nel campione con 10% di Zn). Questo “stress” indotto dallo zinco (microstrain) modifica la struttura a livello atomico.
- Composizione (EDX): Un’analisi chiamata EDX ci ha confermato la presenza effettiva dello zinco nelle quantità desiderate nei campioni drogati. Missione compiuta!
- Morfologia (FESEM e TEM): Guardando le nanoparticelle con microscopi elettronici potentissimi (FESEM e TEM), abbiamo visto il cambiamento anche nella forma. Il Mn2O3 puro mostrava particelle arrotondate e cubiche. Con l’aggiunta di zinco, la forma tendeva al tetragonale e le particelle diventavano più piccole (fino a 5-30 nm per il 10% Zn). Il campione con più zinco mostrava anche una struttura quasi “spugnosa”, con pori molto fini. Questa riduzione di dimensione e cambio di morfologia è proprio legata all’inserimento dello zinco nella struttura.

Interazione con la Luce: Il Cuore della Fotocatalisi
Ok, le nanoparticelle erano diverse. Ma questo come influisce sulla loro capacità di usare la luce? Qui le cose si fanno davvero interessanti!
- Assorbimento della Luce (UV-Vis DRS): Abbiamo misurato quanta luce assorbono i nostri campioni a diverse lunghezze d’onda. Il risultato più eclatante è stato la riduzione del band gap ottico. Cos’è il band gap? Immaginatelo come l’energia minima che serve per “accendere” il materiale e farlo funzionare come fotocatalizzatore. Nel Mn2O3 puro, questo valore era 2.26 eV. Con il 10% di zinco, siamo scesi a 1.89 eV! Questo è fantastico, perché un band gap più basso significa che serve meno energia per attivare il materiale, e quindi può usare una porzione maggiore dello spettro della luce visibile, quella più abbondante nella luce solare. Questo fenomeno, chiamato “red shift” (spostamento verso il rosso), è dovuto proprio agli atomi di zinco che introducono nuovi stati energetici nella struttura.
- Fotoluminescenza (PL): Abbiamo anche studiato come i materiali riemettono luce dopo essere stati eccitati. Abbiamo osservato dei picchi di emissione a specifiche lunghezze d’onda (425, 466, 563, 623 nm), associati a difetti nella struttura cristallina (come le “vacancies” di ossigeno) e agli stati elettronici del manganese. La cosa notevole è che l’intensità di questi picchi aumentava con la quantità di zinco. Questo suggerisce che il drogaggio con zinco non solo modifica il band gap, ma aumenta anche la presenza di questi difetti superficiali, che possono agire come “trappole” per le cariche elettriche generate dalla luce, riducendo la loro ricombinazione e aumentando potenzialmente l’efficienza fotocatalitica. In pratica, più difetti utili, più attività!
All’opera! Degradare un Inquinante Colorato
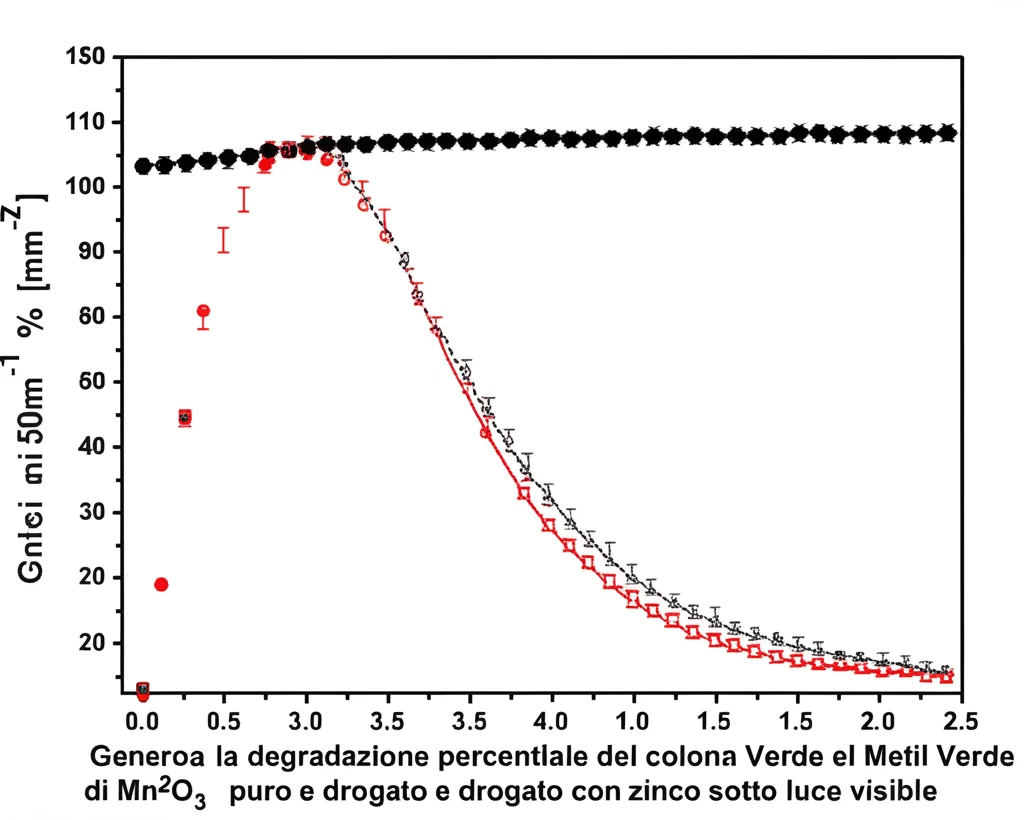
Era il momento della verità: mettere alla prova le nostre nanoparticelle potenziate. Abbiamo scelto un colorante organico comune, il Metil Verde (MG), come “vittima” rappresentativa degli inquinanti industriali. Abbiamo mescolato le nanoparticelle (sia pure che drogate) con una soluzione di MG e abbiamo illuminato il tutto con una lampada a luce visibile.
I risultati sono stati entusiasmanti! Dopo 90 minuti:
- Il Mn2O3 puro ha degradato circa il 40% del colorante.
- Il campione con 3% di Zn è salito al 44.5%.
- Il campione con 5% di Zn ha raggiunto il 57%.
- Il campione con 10% di Zn ha toccato un impressionante 70%!
Abbiamo poi ottimizzato le condizioni: lavorando a pH 7 (neutro), con una dose di catalizzatore di 1.5 g/L e una concentrazione iniziale di colorante di 20 mg/L, il campione 10% ZnMn2O4 ha raggiunto il 97.5% di degradazione del Metil Verde in soli 90 minuti! Un risultato notevole, superiore a molti altri materiali testati in letteratura per lo stesso colorante, soprattutto considerando che abbiamo usato luce visibile.
Come funziona? La luce eccita gli elettroni nel materiale drogato (grazie al band gap ridotto). Questi elettroni reagiscono con l’ossigeno per formare radicali superossido ((:{O}_{2}^{.-})), mentre le “lacune” lasciate dagli elettroni reagiscono con l’acqua per formare radicali idrossile ((::{text{O}text{H}}^{.})). Sono proprio questi radicali super reattivi ad attaccare e distruggere le molecole del colorante.
Abbiamo anche verificato la stabilità: il campione 10% Zn è stato riutilizzato per 10 cicli consecutivi, mantenendo ancora un’efficienza del 77% all’ultimo ciclo. Ottimo segno per potenziali applicazioni reali!
Non solo Inquinanti: Guerra ai Batteri!
Ma le sorprese non erano finite. Volevamo vedere se il drogaggio con zinco avesse potenziato anche le proprietà antibatteriche. Abbiamo testato i nostri campioni contro un gruppo di nemici microscopici piuttosto noti:
- Batteri Gram-positivi: Staphylococcus aureus (spesso causa di infezioni cutanee e non solo) ed Enterococcus faecalis.
- Batteri Gram-negativi: Escherichia coli (alcuni ceppi sono patogeni), Klebsiella pneumoniae (infezioni respiratorie e urinarie) e Pseudomonas aeruginosa (noto per la sua resistenza).
- Un fungo (lievito): Candida albicans.
Abbiamo usato il metodo della diffusione su agar: in pratica, si mettono i campioni su una piastra dove sono stati “seminati” i batteri e si misura l’alone (zona di inibizione) dove i batteri non riescono a crescere.
Anche qui, lo zinco ha fatto la differenza! Il Mn2O3 puro mostrava un’attività limitata solo contro S. aureus ed E. coli. Ma i campioni drogati, specialmente quelli con 5% e 10% di zinco, hanno mostrato un’attività significativamente maggiore contro tutti i microrganismi testati. Ad esempio, contro E. coli, il campione 10% Zn ha creato una zona di inibizione di 12 mm, e contro P. aeruginosa di 10.5 mm. Abbiamo anche determinato la Concentrazione Minima Inibente (MIC), che per i campioni più attivi era di 10 mg/mL contro E. coli e P. aeruginosa.
Il meccanismo? È doppio! Da un lato, gli ioni zinco (Zn²⁺) che possono essere rilasciati dalle nanoparticelle sono tossici per i batteri: danneggiano le loro membrane cellulari e interferiscono con i loro processi vitali. Dall’altro lato, l’attività fotocatalitica (che genera i famosi radicali ROS) contribuisce a danneggiare le cellule batteriche. È un effetto sinergico: lo zinco potenzia la generazione di ROS e rilascia ioni tossici, rendendo queste nanoparticelle dei nemici formidabili per i batteri.

Conclusioni: Un Materiale, Doppia Azione
Questa ricerca è stata davvero gratificante. Siamo riusciti a prendere un materiale promettente come l’ossido di manganese e, con un “semplice” drogaggio con zinco, ne abbiamo potenziato enormemente le capacità. Abbiamo ottenuto nanoparticelle che non solo sono molto più efficienti nel degradare inquinanti organici sotto luce visibile (un passo avanti per la purificazione dell’acqua), ma mostrano anche una forte attività antibatterica contro un’ampia gamma di patogeni.
Questo lavoro dimostra come, giocando con la composizione e la struttura dei materiali a livello nanometrico, possiamo creare soluzioni innovative per affrontare sfide globali interconnesse come l’inquinamento e le infezioni. Le nanoparticelle di Mn2O3 drogate con zinco si sono rivelate un alleato potente e versatile, pronto, spero, per future applicazioni nel campo ambientale e sanitario!
Fonte: Springer







