Lignina Sotto Tensione: Come l’Elettrochimica e la Chemometria Svelano i Segreti della sua Ossidazione
Ciao a tutti! Oggi voglio parlarvi di qualcosa che mi appassiona tantissimo: come possiamo trasformare uno “scarto” abbondante come la lignina in qualcosa di prezioso, usando un pizzico di elettricità e tanta intelligenza artificiale (o quasi!). Immaginate la lignina: è quel componente legnoso che dà rigidità alle piante e costituisce circa il 30% del carbonio organico del nostro pianeta. Un’alternativa pazzesca ai combustibili fossili, no? Ricca di anelli aromatici e gruppi funzionali, è una miniera d’oro potenziale per l’industria chimica.
Il Problema della Lignina: Bella ma Complicata
La lignina è un biopolimero complesso, una specie di puzzle tridimensionale fatto di unità diverse (S, G, H) collegate in modi intricati. Rompere questi legami per ottenere molecole più piccole e utili (un processo chiamato depolimerizzazione) non è una passeggiata. Tra le varie tecniche, l’ossidazione è interessante perché può dare composti di valore senza produrre catrame fastidioso. Però, il risultato è spesso un miscuglio complesso, difficile da controllare.
L’Elettrochimica: Una Scintilla di Speranza (e Sostenibilità)
Qui entra in gioco l’ossidazione elettrochimica. È un metodo più “gentile” ed ecologico: funziona a basse temperature e pressioni, in soluzioni alcaline moderate, e non inquina. In pratica, usiamo la corrente elettrica per “spezzettare” la lignina. Il bello è che possiamo controllare il processo agendo sul potenziale elettrico applicato, cercando di ottenere prodotti più specifici. E c’è un bonus: si può co-generare idrogeno, un carburante pulito!
Certo, non è tutto oro quello che luccica. L’ossidazione elettrochimica può consumare parecchia energia e gli elettrodi (le superfici dove avviene la reazione) possono “sporcarsi” e smettere di funzionare. Per questo, la ricerca si concentra su elettrocatalizzatori efficienti e a basso costo, come quelli a base di Nichel-Cobalto (Ni-Co) che abbiamo usato nel nostro studio.
La Domanda Cruciale: Chi Comanda la Reazione?
Da tempo si sospettava che durante l’ossidazione elettrochimica si formassero dei “killer” chimici molto reattivi, i radicali ossidrilici (•OH). Ma la domanda fondamentale era: è la superficie dell’elettrodo a fare direttamente il lavoro di rottura della lignina, o sono questi radicali a guidare la danza? Capirlo è essenziale per ottimizzare il processo. Se non controlliamo il meccanismo, rischiamo di produrre un sacco di composti indesiderati, rendendo il tutto economicamente svantaggioso.
Il Nostro Approccio: Un Modello Semplice e uno “Spazzino” di Radicali
Per vederci chiaro, abbiamo semplificato il problema. Invece della lignina vera e propria, abbiamo usato un suo “sosia” ben studiato, una molecola modello chiamata benzil fenil etere (BPE). Abbiamo ossidato il BPE usando il nostro elettrocatalizzatore Ni-Co a diversi potenziali elettrici (0.6, 0.8 e 1.0 Volt, scelti apposta per favorire l’ossidazione rispetto alla produzione di ossigeno, che spreca energia).
E qui arriva l’idea chiave: abbiamo diviso i nostri esperimenti in due set. In uno, abbiamo condotto l’ossidazione normalmente. Nell’altro, abbiamo aggiunto una sostanza chiamata dimetilsolfossido (DMSO), che è un noto “spazzino” di radicali •OH. L’ipotesi era semplice:
- Se la reazione avviene principalmente per via elettrochimica diretta, aggiungere il DMSO non dovrebbe cambiare molto i prodotti ottenuti.
- Se invece i radicali •OH sono i protagonisti, eliminarli con il DMSO dovrebbe alterare significativamente il risultato dell’ossidazione.

Analisi da Detective: GC-MS e Chemometria
Dopo ogni esperimento di ossidazione (durato 10 ore!), abbiamo analizzato i prodotti formati. Come? Con una tecnica super potente chiamata SPME-GC-MS (Microestrazione in Fase Solida nello Spazio di Testa accoppiata alla Gascromatografia-Spettrometria di Massa). In pratica, “annusiamo” i vapori sopra il campione per catturare le molecole volatili prodotte e poi le separiamo e identifichiamo.
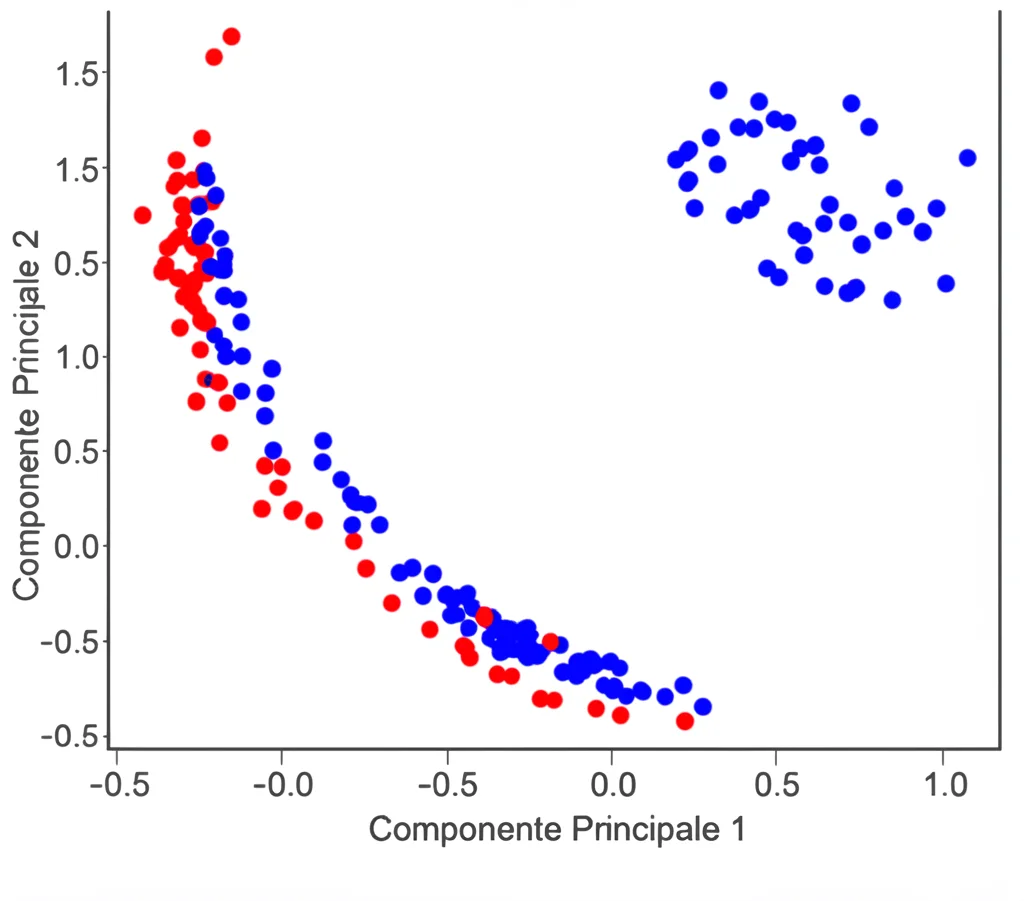
Ma i dati ottenuti dalla GC-MS sono tantissimi e complessi: picchi su picchi, spettri di massa… un vero groviglio! Per districarlo e capire le differenze *reali* tra i campioni trattati con e senza DMSO, abbiamo usato la chemometria, in particolare l’Analisi Fattoriale (FA). Pensatela come un investigatore statistico che analizza tutte le prove (i dati GC-MS) e trova gli schemi nascosti, evidenziando le differenze significative tra i gruppi di campioni (con vs senza DMSO, diversi potenziali). È un approccio innovativo per studiare meccanismi di reazione complessi come questo.
Il Verdetto: I Radicali Guidano la Danza!
I risultati sono stati illuminanti! Analizzando i dati con la chemometria, abbiamo visto differenze nette e statisticamente significative tra i campioni ossidati con e senza DMSO, a tutti e tre i potenziali testati (0.6, 0.8 e 1.0 V).
Cosa significa? Significa che i radicali ossidrilici (•OH) giocano un ruolo primario nella depolimerizzazione elettrochimica del nostro modello di lignina. Quando li abbiamo “spazzati via” con il DMSO, la reazione è cambiata, producendo meno frammenti o prodotti diversi. Certo, anche l’ossidazione diretta sulla superficie dell’elettrodo avviene, ma sembra essere un meccanismo secondario.
Abbiamo anche confermato che un potenziale più alto (1.0 V) porta a una maggiore formazione di prodotti di ossidazione, indicando una depolimerizzazione più efficace. A 0.6 V, invece, la reazione era molto meno spinta, come ci aspettavamo. Curiosamente, in alcuni casi abbiamo trovato molecole più grandi del BPE di partenza, suggerendo che possano avvenire anche reazioni secondarie di polimerizzazione o riarrangiamento.

Perché è Importante? Verso una Chimica più Verde
Capire che sono i radicali •OH i principali attori ci dà un’informazione cruciale. Ora possiamo pensare a come controllare meglio la loro formazione o il loro intervento per rendere il processo di depolimerizzazione della lignina più selettivo (ottenere i prodotti che vogliamo) ed efficiente. Questo apre la strada a strategie migliori per la valorizzazione della biomassa, trasformando un rifiuto in preziose sostanze chimiche aromatiche (fenoli, acidi, ecc.) in modo sostenibile.
L’accoppiata elettrochimica-chemometria si è rivelata potentissima per svelare i dettagli intimi di una reazione complessa. È un esempio di come l’analisi avanzata dei dati possa guidare la ricerca verso soluzioni più intelligenti ed ecologiche.
Prossimi Passi: Dalla Molecola Modello alla Lignina Vera
Questo studio sul benzil fenil etere è stato un passo fondamentale. Ora siamo pronti per la sfida successiva: applicare lo stesso approccio alla lignina vera, estratta da scarti di biomassa. Sarà più complesso, ma le conoscenze acquisite sul meccanismo ci guideranno. L’obiettivo finale è contribuire allo sviluppo di tecnologie per convertire la lignina in modo economico e sostenibile, riducendo la nostra dipendenza dai fossili e aprendo nuove vie per la chimica verde.
Insomma, la strada per valorizzare appieno la lignina è ancora lunga, ma grazie a strumenti come l’elettrochimica e la chemometria, stiamo facendo passi da gigante per capire come “domarla” e sfruttarne l’enorme potenziale. Rimanete sintonizzati per i prossimi sviluppi!
Fonte: Springer