Origini del DNA: Come le Cellule Scelgono Dove Iniziare la Copia (e Tengono le Riserve Pronte!)
Ciao a tutti! Oggi voglio portarvi con me in un viaggio affascinante nel cuore delle nostre cellule, per scoprire uno dei segreti meglio custoditi della vita: come fa il nostro DNA a duplicarsi in modo così preciso e ordinato? Sembra semplice, ma vi assicuro che è un processo incredibilmente complesso e regolato finemente.
Il Dilemma delle Origini: Attive vs Dormienti
Immaginate il nostro genoma come un’enorme enciclopedia che deve essere copiata perfettamente ogni volta che una cellula si divide. La copia non inizia da un punto qualsiasi, ma da migliaia di siti specifici chiamati origini di replicazione. Pensate a loro come ai segnalibri che indicano dove iniziare a leggere (o, in questo caso, a copiare).
Ora, la cosa curiosa è questa: anche se ci sono tantissime potenziali origini pronte all’uso, con tutti i macchinari necessari (i cosiddetti complessi pre-replicativi o pre-RC), solo un gruppo selezionato viene effettivamente attivato durante una normale divisione cellulare. Queste sono le origini “baseline”, quelle che fanno il lavoro di routine.
Ma allora, che fine fanno le altre? Restano lì, pronte ma silenziose. Sono le origini “dormienti”. Perché esistono? Beh, sono una sorta di piano B, una squadra di pronto intervento. Se qualcosa va storto durante la replicazione – ad esempio, se il processo si blocca a causa di danni al DNA (quello che chiamiamo stress replicativo) – queste origini dormienti possono essere svegliate e attivate per assicurare che l’intera enciclopedia venga copiata, anche se con qualche intoppo lungo la strada. È un meccanismo fondamentale per proteggere il nostro genoma da errori catastrofici.
La domanda che ci siamo posti è: come fa la cellula a sapere quali origini attivare subito e quali tenere in panchina? Sembrano tutte uguali a prima vista, con gli stessi complessi pre-RC. Qui entra in gioco la scoperta di cui vi parlo oggi.
I Protagonisti della Scelta
Per capire questo meccanismo di selezione, dobbiamo conoscere alcuni attori chiave:
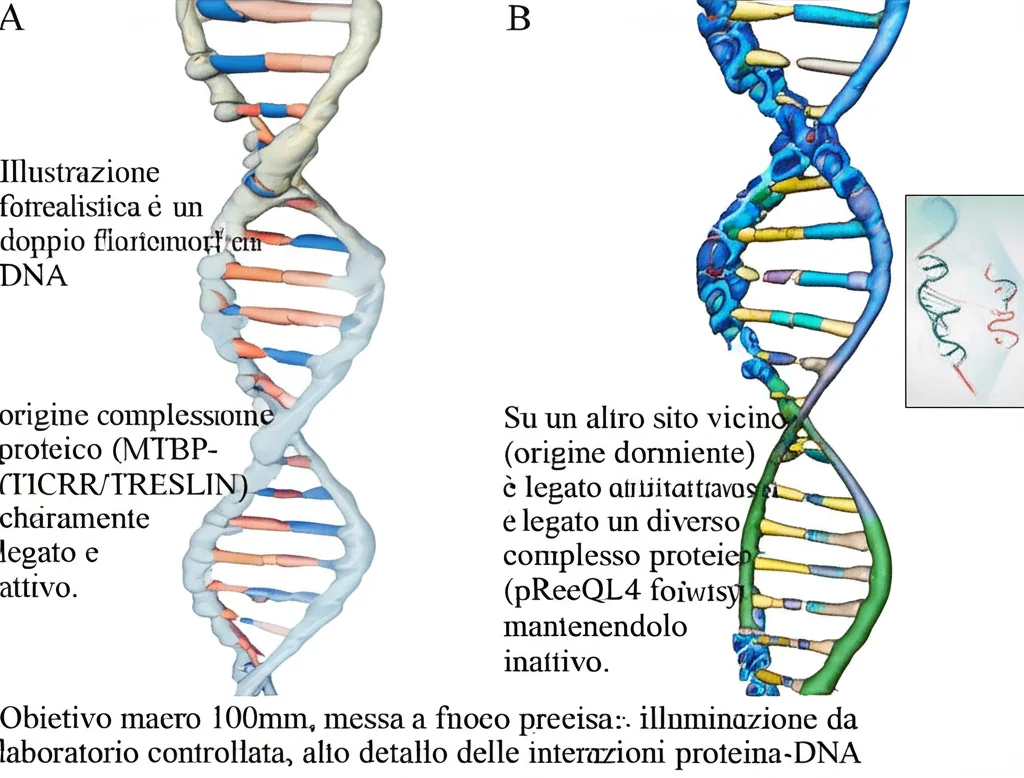
- Complessi pre-RC (pre-Replication Complexes): Le “squadre di preparazione” che si assemblano sulle origini in una fase specifica del ciclo cellulare (la fase G1). Comprendono proteine come ORC, CDC6, CDT1 e l’elicasi MCM2-7 (una sorta di “apri-cerniera” del DNA).
- Complesso MTBP-TICRR/TRESLIN: Un duo di proteine essenziale per dare il via alla replicazione. Funziona come l’interruttore che trasforma un pre-RC pronto in una macchina di replicazione attiva.
- RecQL4: Un’altra proteina importante, un’elicasi della famiglia RecQ. È interessante perché mutazioni nel suo gene causano malattie genetiche rare (come la sindrome di Rothmund-Thomson) associate a problemi di sviluppo, invecchiamento precoce e predisposizione al cancro. RecQL4 può interagire con i componenti dei pre-RC.
- pRecQL4-S89: Una forma specifica di RecQL4 che è stata “modificata” chimicamente (fosforilata) su un particolare amminoacido (la Serina 89). Questa modifica è spesso un segnale per cambiare l’attività o la localizzazione di una proteina.
- SIRT1 e ATR: Due “registi” che orchestrano la risposta allo stress replicativo e sembrano coinvolti nella decisione di attivare o meno le origini dormienti.
La Danza delle Molecole: Chi Va Dove?
Utilizzando tecniche sofisticate che ci permettono di “vedere” dove si legano specifiche proteine sul DNA (come la ChIP-Seq) e di mappare dove inizia la replicazione (NS-seq), abbiamo fatto una scoperta sorprendente nelle cellule umane (in particolare, linee cellulari HCT116 e fibroblasti).
In condizioni normali, quando le cellule crescono felici e indisturbate:
- Il complesso MTBP-TICRR/TRESLIN si lega preferenzialmente alle origini baseline. È come se mettesse un’etichetta “Pronto per partire!” solo su queste.
- La forma fosforilata pRecQL4-S89, invece, si trova legata selettivamente alle origini dormienti. Sembra quasi che dica: “Tu, per ora, stai fermo”.
Questa separazione è netta. Le origini che legano MTBP-TICRR/TRESLIN sono quelle attive, mentre quelle che legano pRecQL4-S89 restano inattive. Abbiamo anche visto che questa associazione dipende dalla presenza dei complessi pre-RC e da una specifica modifica (fosforilazione sulla Serina 139) sull’elicasi MCM2, che è nota per essere cruciale per l’inizio della replicazione proprio sulle origini baseline.
Curiosamente, abbiamo osservato che il legame di MTBP-TICRR/TRESLIN alle origini baseline avviene proprio poco prima che la replicazione inizi in quella specifica regione del genoma, seguendo la “tabella di marcia” temporale della replicazione (alcune regioni vengono copiate prima, altre dopo, durante la fase S del ciclo cellulare). pRecQL4-S89, invece, sembra arrivare sulle origini dormienti un po’ più tardi, forse dopo che sono state già copiate passivamente dalle “macchine” partite dalle origini baseline vicine, quasi a marcarle per evitare che partano anch’esse.
Sotto Stress: Quando le Riserve Entrano in Gioco
Cosa succede quando mettiamo le cellule sotto pressione, simulando uno stress replicativo (ad esempio, usando una sostanza chiamata afidicolina, APH, che blocca la sintesi del DNA)? Qui le cose cambiano drasticamente.
Abbiamo visto che, in risposta allo stress:
- Il complesso MTBP-TICRR/TRESLIN si stacca dalle origini baseline. È come se l’ordine di partenza venisse temporaneamente sospeso.
- Contemporaneamente, aumenta il legame di pRecQL4-S89 alla cromatina (il complesso DNA-proteine).
- Quando lo stress viene rimosso e le cellule iniziano a recuperare, succede qualcosa di cruciale: MTBP-TICRR/TRESLIN non torna solo sulle origini baseline, ma si ridistribuisce e va a legarsi anche alle origini dormienti!
Questa ridistribuzione permette alle origini dormienti, precedentemente silenziate, di attivarsi e iniziare la replicazione, aiutando così la cellula a completare la copia del genoma nonostante l’intoppo iniziale. È la squadra di riserva che entra in campo!
E qui arriva un altro punto chiave: questa capacità di staccare MTBP dalle origini baseline e poi ridistribuirlo anche alle dormienti dipende proprio dalla presenza di RecQL4 e dalla sua capacità di essere fosforilata sulla Serina 89 (pRecQL4-S89).
Abbiamo creato cellule in cui RecQL4 non poteva essere fosforilata in quel punto (mutante RecQL4-S89A). In queste cellule:
- Durante la crescita normale, MTBP si legava anche alle origini dormienti (perché mancava il “freno” pRecQL4-S89), attivandole impropriamente.
- Sotto stress da APH, MTBP non si staccava dalle origini baseline come avrebbe dovuto.
- Di conseguenza, queste cellule facevano molta più fatica a recuperare dallo stress replicativo, mostravano più segni di danno al DNA (come la presenza di DNA a singolo filamento indicato da RPA e il marcatore γH2AX) e sopravvivevano molto meno dopo un’esposizione prolungata all’APH.
Questo ci dice che la fosforilazione di RecQL4 su S89 è essenziale non solo per tenere a bada le origini dormienti in condizioni normali, ma anche per orchestrare la risposta corretta allo stress, permettendo il distacco temporaneo di MTBP e la sua successiva ridistribuzione salvifica.
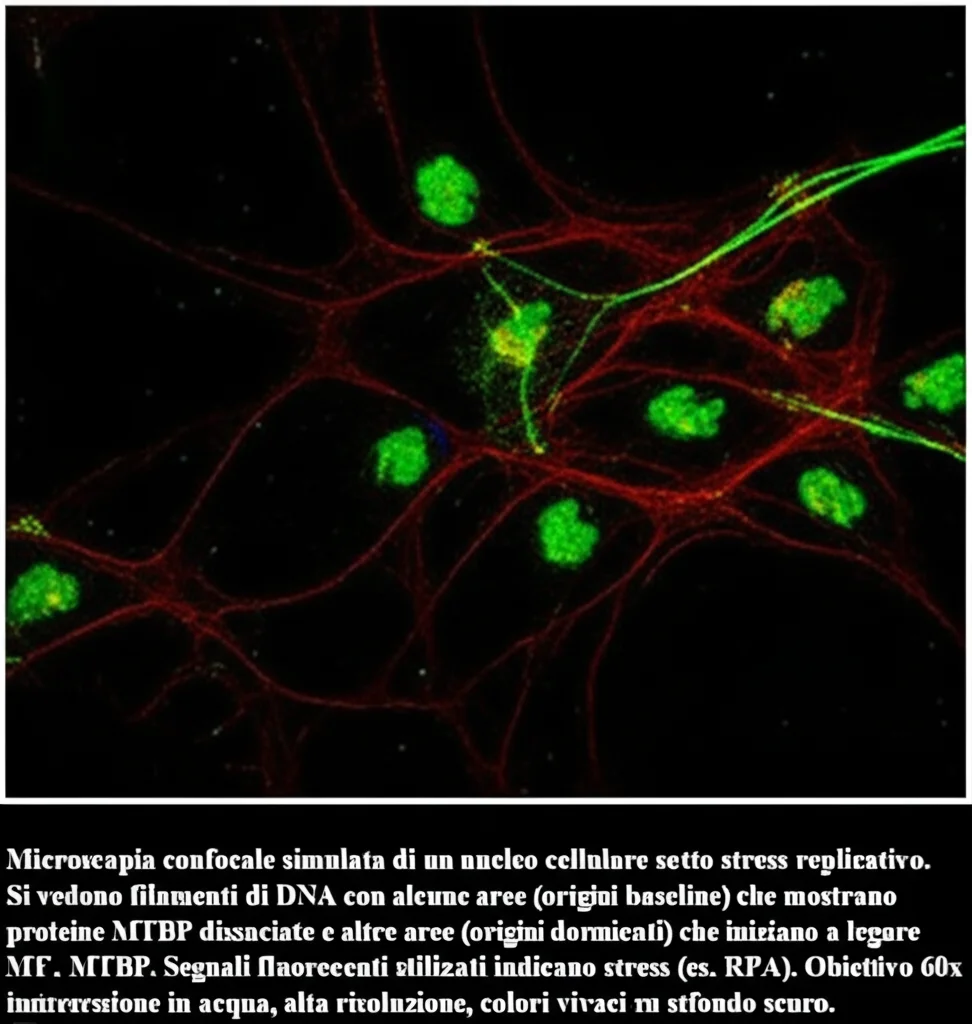
Il Meccanismo nel Dettaglio: Fosforilazioni Chiave
Sembra quindi che pRecQL4-S89 agisca come un guardiano per le origini dormienti, impedendo fisicamente o funzionalmente al complesso MTBP-TICRR/TRESLIN di legarsi e dare il via alla replicazione quando non è necessario.
Ma come fa la cellula a “sbloccare” le origini dormienti quando serve? Qui entra in gioco un’altra modifica sull’elicasi MCM2, la fosforilazione sulla Serina 108 (MCM2-S108), mediata dalla chinasi ATR (un sensore chiave dello stress replicativo). Abbiamo visto in studi precedenti, e confermato qui, che questa fosforilazione S108 è necessaria per attivare le origini dormienti sotto stress. Ora capiamo meglio perché: sembra che la presenza di una Serina intatta in posizione 108 su MCM2 sia un requisito fondamentale affinché sia pRecQL4-S89 sia MTBP possano interagire correttamente con le origini dormienti.
Se mutiamo S108 in Alanina (che non può essere fosforilata), né pRecQL4-S89 né MTBP si legano più alle origini dormienti, nemmeno se proviamo ad attivarle artificialmente (ad esempio inibendo SIRT1). Questo suggerisce uno scenario complesso:
- Normalmente, MCM2-S108 intatta permette a pRecQL4-S89 di legarsi alle origini dormienti, inibendole.
- Sotto stress, ATR fosforila MCM2-S108. Questo, insieme ad altri segnali (come la fosforilazione di MCM2-S139 anche sulle dormienti), porta al distacco di pRecQL4-S89 e permette a MTBP-TICRR/TRESLIN di legarsi e attivare la replicazione.
- Se manca pRecQL4-S89 (o RecQL4 stessa), MTBP può legarsi alle dormienti anche senza stress, causando potenzialmente problemi.
- Se manca la possibilità di fosforilare MCM2-S108, le origini dormienti non possono essere né adeguatamente silenziate da pRecQL4 né attivate da MTBP sotto stress, rendendo la cellula vulnerabile.
Perché Tutto Questo è Cruciale?
Questa danza molecolare tra MTBP-TICRR/TRESLIN e pRecQL4-S89 sulle origini di replicazione è fondamentale per la vita della cellula.
- Ordine e Stabilità: Distinguere tra origini baseline e dormienti permette alla cellula di seguire una precisa “tabella di marcia” per la replicazione (il cosiddetto “replication timing”), che è importante per coordinare la copia del DNA con altre attività come la trascrizione dei geni ed evitare collisioni pericolose.
- Flessibilità e Sicurezza: Avere origini dormienti di riserva garantisce che, anche in caso di problemi, l’intero genoma possa essere duplicato. Questo previene la perdita di informazione genetica e la formazione di rotture cromosomiche.
- Evitare l’Eccesso: Allo stesso tempo, attivare troppe origini contemporaneamente può essere dannoso, portando a instabilità genomica. Il controllo esercitato da pRecQL4-S89 previene questo scenario in condizioni normali.
- Risposta allo Stress: La capacità di “riprogrammare” l’uso delle origini sotto stress, grazie alla dinamica MTBP/pRecQL4, è vitale per la sopravvivenza cellulare di fronte a danni al DNA o blocchi della replicazione.
Capire questi meccanismi è importantissimo. RecQL4 è legata a malattie dell’invecchiamento e al cancro. Le cellule tumorali, spesso sottoposte a forte stress replicativo a causa della loro crescita incontrollata, potrebbero dipendere in modo particolare dalle origini dormienti per sopravvivere. Studiare come queste origini sono regolate potrebbe aprire nuove strade per terapie mirate, magari trovando il modo di “spegnere” le riserve delle cellule cancerose per renderle più vulnerabili.
Insomma, la prossima volta che pensate alla divisione cellulare, ricordatevi di questa incredibile strategia di gestione delle risorse che avviene nel nostro DNA, con proteine che agiscono come vigili urbani molecolari, decidendo chi parte subito e chi resta in attesa, pronte a intervenire in caso di emergenza. È un equilibrio delicato ma essenziale per mantenerci sani!
Fonte: Springer