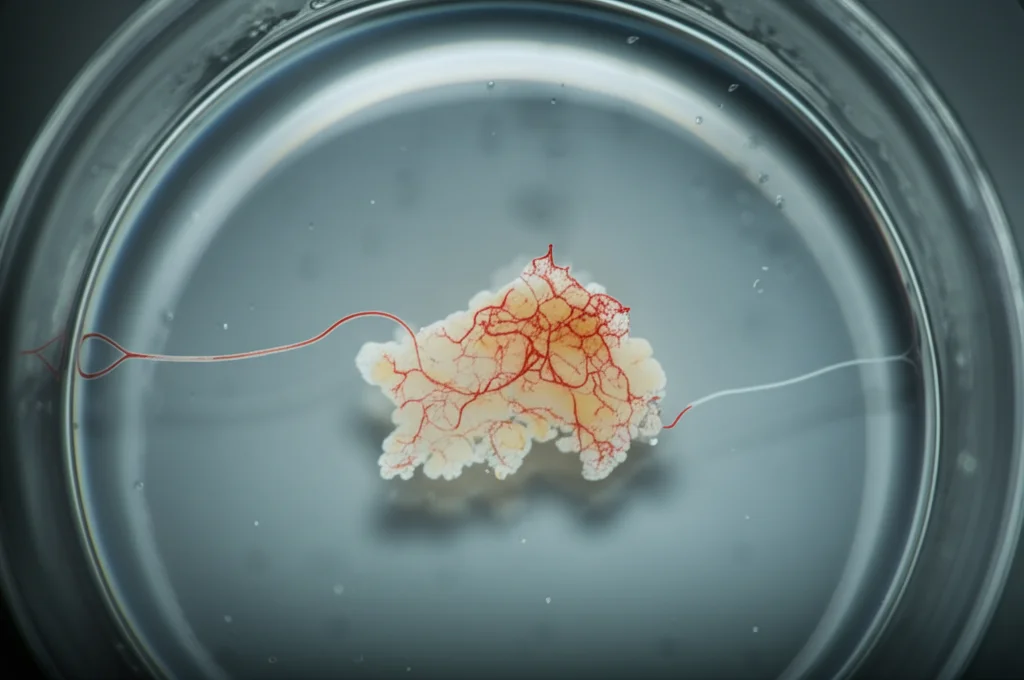
Mini-Cervelli con Vasi Sanguigni: La Nostra Finestra sui Danni da Ipossia Neonatale
Ciao a tutti! Oggi voglio parlarvi di qualcosa di veramente affascinante e, purtroppo, molto serio: i danni cerebrali che possono colpire i neonati a causa della mancanza di ossigeno, una condizione chiamata ipossia o encefalopatia ipossico-ischemica (HIE). È un evento tragico, con un’incidenza che tocca da due a quattro bambini su mille, e può portare a disabilità neurologiche permanenti come paralisi cerebrali o deficit intellettivi.
Capire cosa succede esattamente nel cervello umano durante questi eventi è fondamentale, ma incredibilmente difficile. Non possiamo certo prelevare campioni dal cervello di un neonato in difficoltà! I modelli animali ci danno una mano, certo, ma il cervello umano ha le sue peculiarità. Ecco perché nel nostro laboratorio ci siamo buttati a capofitto su una tecnologia pazzesca: gli organoidi cerebrali.
Cosa sono gli Organoidi Cerebrali?
Immaginate dei “mini-cervelli” coltivati in laboratorio a partire da cellule staminali. Questi organoidi (noi li chiamiamo Cors) riescono a mimare alcune fasi dello sviluppo cerebrale umano in vitro. Fantastico, no? Diversi studi li hanno già usati per simulare l’HIE, esponendoli a bassi livelli di ossigeno e osservando cosa succede. Ad esempio, si è visto che un tipo specifico di cellule progenitrici neurali, quelle positive alla proteina T-box brain 2 (TBR2+), chiamate progenitori intermedi (IPs), sono particolarmente vulnerabili all’ipossia nei Cors.
Ma c’era un “però”. Questi modelli, per quanto utili, mancavano di alcuni pezzi fondamentali: i vasi sanguigni e le cellule immunitarie del cervello, le microglia. Sappiamo che entrambi giocano ruoli cruciali nello sviluppo cerebrale e, soprattutto, nella risposta ai danni. I vasi portano ossigeno e nutrienti, ma possono anche contribuire all’infiammazione o rilasciare fattori protettivi. La microglia, invece, è la prima linea di difesa immunitaria nel cervello.
Creare un Modello Più Realistico: Nascono gli FVCors
Qui entra in gioco la nostra idea: perché non creare un organoide cerebrale che includesse anche i vasi sanguigni e la microglia? Detto, fatto! Abbiamo sviluppato una tecnica per “fondere” insieme organoidi cerebrali (derivati dall’ectoderma, il foglietto embrionale che dà origine al sistema nervoso) con organoidi vascolari (derivati dal mesoderma, quello che dà origine ai vasi). Li abbiamo chiamati organoidi cerebrali vascolarizzati fusi (FVCors).
Questi FVCors sono molto più complessi: sviluppano strutture simili a reti vascolari, con cellule endoteliali e periciti, e contengono anche microglia attiva derivata dalle cellule vascolari. Sembrano davvero un passo avanti per mimare il cervello umano in modo più fedele.
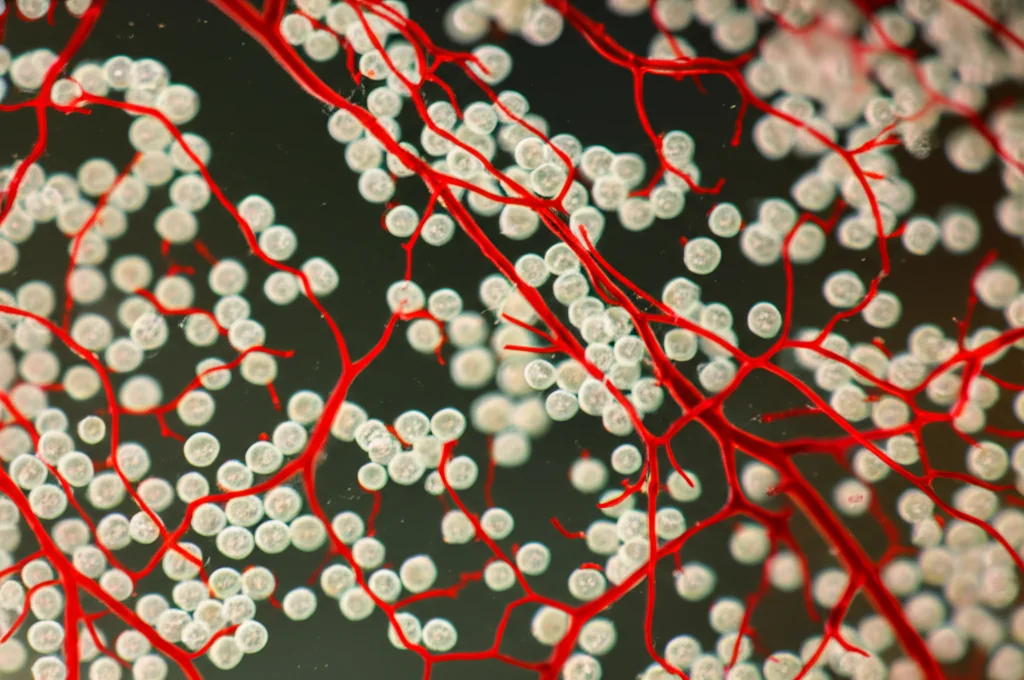
Sotto Stress: Cosa Succede Senza Ossigeno?
Una volta ottenuto il nostro modello FVCors, siamo passati all’esperimento cruciale. Abbiamo preso questi organoidi, insieme ai Cors “semplici” come controllo, e li abbiamo messi in una camera speciale con una concentrazione di ossigeno bassissima (0.6% O2) per 48 ore, simulando una grave condizione di ipossia. Volevamo vedere come reagivano le cellule neurali in presenza dei vasi sanguigni.
Per prima cosa, abbiamo verificato che l’ipossia fosse stata indotta correttamente. Abbiamo cercato una proteina chiamata HIF-1α (Hypoxia-Inducible Factor-1 alpha), che è come un sensore della mancanza di ossigeno. Ebbene sì, i livelli di HIF-1α erano aumentati sia nei Cors che negli FVCors esposti a basso ossigeno, confermando che le cellule avevano “sentito” la mancanza di O2. Anzi, negli FVCors la risposta sembrava persino più intensa!
Analisi Approfondita: Cosa Dicono i Geni?
Per capire meglio cosa stesse succedendo a livello molecolare, abbiamo isolato le cellule neurali (quelle non fluorescenti, dato che avevamo marcato le cellule vascolari con una proteina fluorescente verde, GFP) dai nostri FVCors (sia quelli in condizioni normali che quelli ipossici) e abbiamo analizzato quali geni venivano “accesi” o “spenti” (analisi trascrittomica tramite RNA-seq).
I risultati sono stati sorprendenti! Nelle cellule neurali degli FVCors ipossici, abbiamo trovato ben 808 geni la cui espressione era significativamente cambiata rispetto ai controlli. Nei Cors semplici ipossici, invece, i geni alterati erano “solo” 149. Questo ci ha detto subito una cosa: la presenza dei vasi rendeva la risposta all’ipossia molto più complessa e pronunciata.
Analizzando i geni alterati, abbiamo visto che molti di quelli comuni tra Cors e FVCors erano legati, come previsto, alla risposta all’ipossia (ad esempio, geni come SLC2A3 e PDK1). Ma le differenze erano ancora più interessanti.
Negli FVCors ipossici, abbiamo notato l’attivazione di geni legati all’infiammazione (come RELB, IRF9, TNFAIP3), cosa che non avveniva nei Cors semplici. Questo è molto importante, perché l’infiammazione è una componente chiave del danno da HIE osservato clinicamente. Inoltre, negli FVCors ipossici c’era una significativa riduzione dell’espressione di geni coinvolti nella segregazione cromosomica, nella progressione del ciclo cellulare e nello sviluppo degli assoni (i “cavi” di collegamento tra neuroni). Anche questi sono effetti noti dell’ipossia in vivo. Sembrava proprio che i nostri FVCors stessero mimando la situazione reale in modo più accurato.
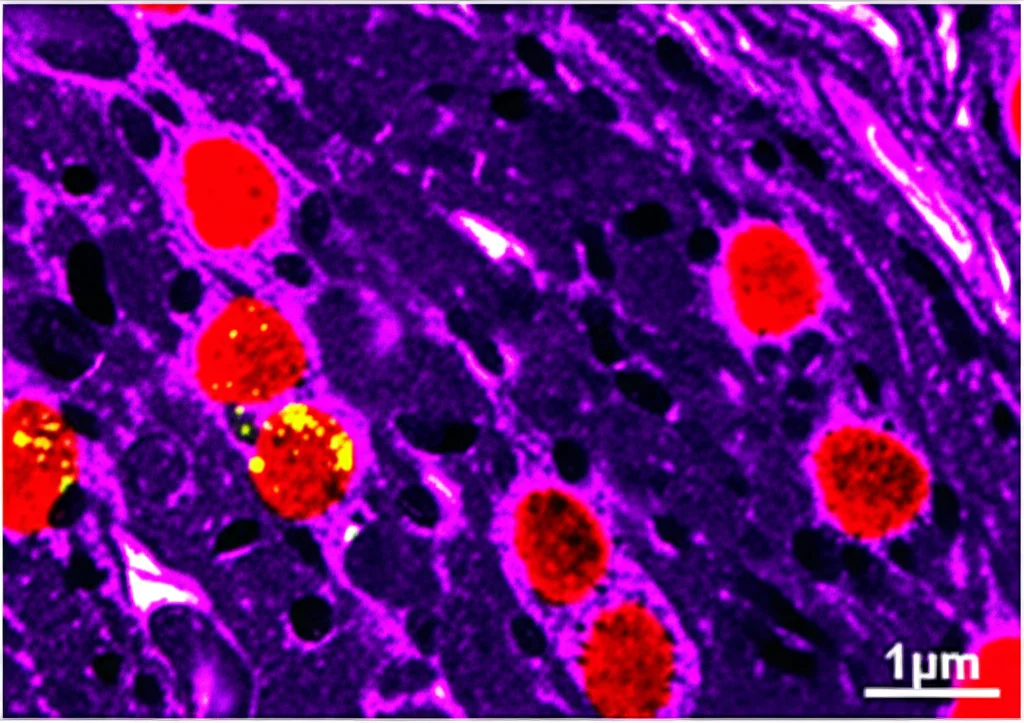
Una Sorpresa Inaspettata: Il Ruolo Protettivo dei Vasi
Ma ecco il colpo di scena. Ricordate quelle cellule progenitrici intermedie (IPs), quelle TBR2+, che erano particolarmente vulnerabili all’ipossia nei Cors semplici? Bene, analizzando i nostri dati, abbiamo visto che il gene che codifica per TBR2 (chiamato EOMES) era sì ridotto nei Cors ipossici, ma questa riduzione era molto meno marcata negli FVCors ipossici!
Siamo andati a vedere direttamente le cellule con la microscopia: ed era proprio così! La densità delle cellule TBR2+ diminuiva nei Cors dopo l’ipossia, ma rimaneva pressoché invariata negli FVCors. Sembrava che i vasi sanguigni, o qualcosa da essi derivato, stesse proteggendo specificamente questo tipo di cellula neurale dalla morte indotta da ipossia. Invece, altri tipi cellulari, come i progenitori neurali PAX6+, non mostravano questa protezione specifica, anche se la loro produzione generale era maggiore negli FVCors (come avevamo già osservato in studi precedenti).
Il Segreto è nel BMP2?
Questa scoperta ci ha elettrizzato. Come facevano i vasi a proteggere le cellule TBR2+? Abbiamo ipotizzato che potessero rilasciare qualche fattore solubile. Così, abbiamo isolato le cellule vascolari (quelle GFP+) dagli FVCors (sia controllo che ipossici) e abbiamo analizzato il loro trascrittoma. Abbiamo cercato geni che codificassero per proteine secrete e la cui espressione cambiasse con l’ipossia.
Tra i candidati, abbiamo notato un arricchimento di geni legati alla via di segnalazione delle proteine morfogenetiche dell’osso (BMP) e alla trasduzione del segnale intracellulare SMAD. In particolare, l’espressione del gene BMP2 risultava aumentata nelle cellule vascolari degli FVCors dopo l’ipossia.
Poteva essere il BMP2 la chiave? Abbiamo verificato l’attivazione della via BMP/SMAD guardando la fosforilazione delle proteine SMAD1/5/8 a valle. Nei Cors ipossici, la segnalazione BMP/SMAD diminuiva. Negli FVCors ipossici, invece, questa diminuzione era molto attenuata, suggerendo che la via rimanesse più attiva grazie alla presenza dei vasi.
Per confermare il ruolo del BMP2, abbiamo fatto un ultimo esperimento: abbiamo trattato i Cors semplici con BMP2 durante l’esposizione all’ipossia. Il risultato? Il trattamento con BMP2 ha riattivato la segnalazione SMAD e, soprattutto, ha prevenuto la perdita delle cellule TBR2+ indotta dall’ipossia! Bingo! Sembra proprio che il BMP2 rilasciato dalle cellule vascolari abbia un effetto neuroprotettivo specifico sugli IPs in condizioni di ipossia.
Cosa Significa Tutto Questo?
Questo studio, secondo me, è un passo avanti importante. Abbiamo dimostrato che il nostro modello di organoide cerebrale vascolarizzato (FVCors) non solo mima più da vicino la complessità della risposta cerebrale all’ipossia in vivo, includendo aspetti come l’infiammazione e specifici danni cellulari, ma ci ha anche permesso di scoprire un meccanismo di neuroprotezione mediato dai vasi sanguigni attraverso il rilascio di BMP2.
Certo, il nostro modello ha ancora dei limiti. Manca il flusso sanguigno reale, e la maturità degli organoidi è ancora lontana da quella di un cervello vero. C’è ancora molta strada da fare per migliorare questi sistemi.
Tuttavia, questi FVCors ci offrono una finestra unica per studiare le interazioni tra cellule diverse (neurali, vascolari, immunitarie) durante lo sviluppo e in condizioni patologiche come l’ipossia, direttamente su un modello umano. E identificare fattori protettivi come il BMP2 apre nuove, potenziali strade per future strategie terapeutiche mirate a proteggere il cervello dei neonati dai devastanti effetti della mancanza di ossigeno. È una ricerca che ci appassiona e che speriamo possa fare la differenza.
Fonte: Springer