Placenta su Chip: La Nostra Finestra Segreta sulla Gravidanza e le Infezioni Virali
Ciao a tutti! Oggi voglio parlarvi di qualcosa che mi appassiona da morire e che potrebbe davvero cambiare il modo in cui studiamo uno degli organi più misteriosi e fondamentali: la placenta. Sì, quell’incredibile interfaccia tra mamma e bambino che protegge il feto in crescita da tutto ciò che potrebbe nuocergli, come farmaci o agenti patogeni.
L’Enigma della Placenta
Pensateci: la placenta è un organo temporaneo, complesso, che svolge mille funzioni cruciali. Fa da scudo, da filtro, da sistema di comunicazione e supporto vitale. Ma studiarla non è affatto semplice, soprattutto nelle primissime fasi della gravidanza, quelle più delicate. I modelli animali? Beh, le placente degli animali sono spesso molto diverse dalla nostra. Le linee cellulari in laboratorio? Utili, certo, ma spesso sono cellule tumorali o immortalizzate, non proprio lo specchio della realtà. Gli espianti di placenta? Si possono usare solo a termine gravidanza, perdendoci tutto quello che succede all’inizio.
Recentemente, abbiamo fatto passi da gigante con gli organoidi trofoblastici (TOs). Si tratta di mini-placente coltivate in 3D a partire da cellule staminali trofoblastiche umane (hTSCs) o cellule staminali pluripotenti indotte (iPSCs). Questi organoidi sono fantastici perché mimano la struttura e le funzioni delle prime villosità placentari. Ci hanno già insegnato tantissimo sullo sviluppo placentare, sulle infezioni virali e sulle complicazioni della gravidanza.
Ma c’era ancora un “ma”. Questi organoidi, per quanto avanzati, rappresentavano solo la componente trofoblastica. Mancava un pezzo fondamentale del puzzle: la nicchia vascolare, cioè la rete di capillari fetali che si sviluppa all’interno dei villi e che è essenziale per la circolazione e gli scambi materno-fetali. Senza questa componente, come potevamo capire davvero le complesse interazioni cellulari che avvengono nella placenta vera?
La Nostra Idea: Unire Organoidi e Microfluidica
Ed è qui che entra in gioco la nostra idea, un po’ folle ma tremendamente affascinante: combinare la potenza degli organoidi con la tecnologia dei “sistemi microfisiologici” (MPS), meglio noti come “organ-on-a-chip”. Abbiamo pensato: e se riuscissimo a far crescere i nostri organoidi placentari direttamente su un chip, in un ambiente che simula la presenza dei vasi sanguigni e il flusso dinamico del sangue?
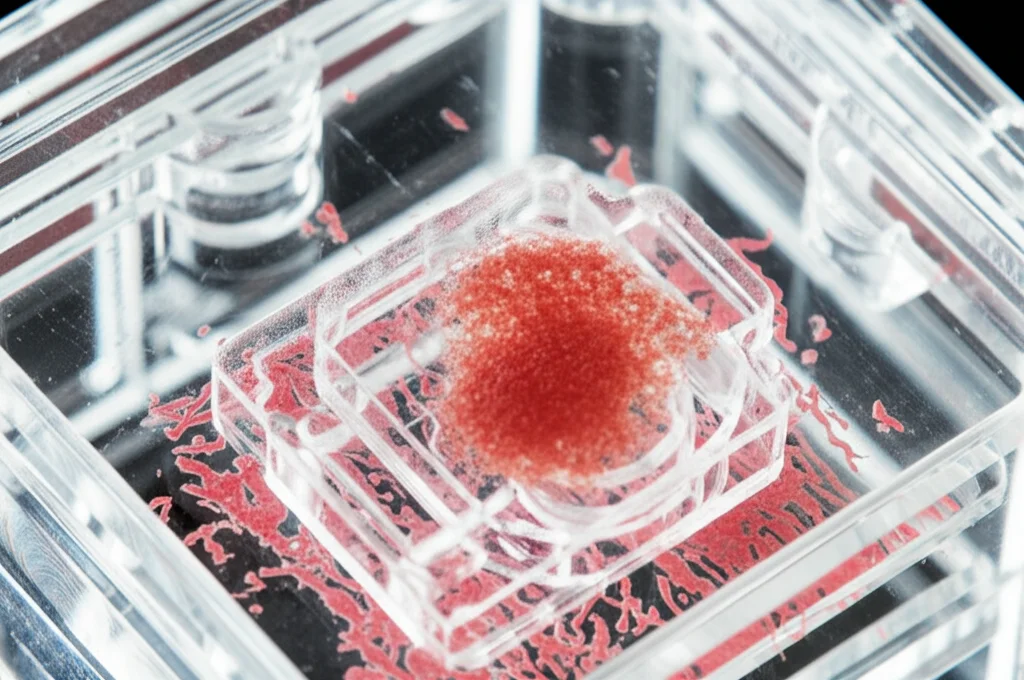
Così, abbiamo progettato e costruito un sistema MPS ad hoc. Immaginate un piccolo dispositivo, un chip speciale chiamato KabellyInsert™, con diverse unità di coltura. Ogni unità ha delle camere dove possiamo far crescere i nostri organoidi placentari (TOs) a partire dalle cellule staminali (hTSCs). Il chip viene poi messo su un “rocker”, una sorta di dondolo, che crea un flusso di liquido costante e delicato, guidato dalla gravità, che mima la circolazione sanguigna.
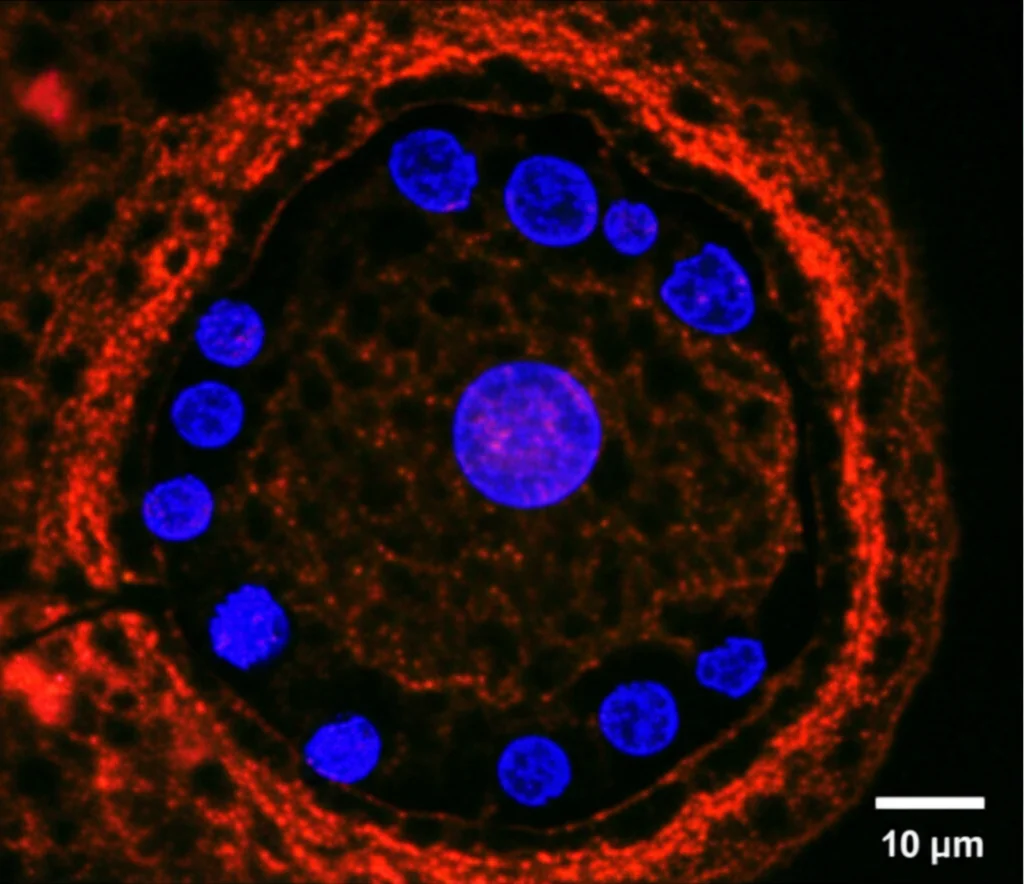
Ma la vera chicca è stata aggiungere l’endotelio. Abbiamo seminato cellule endoteliali umane (HUVEC) sulla parte inferiore di una membrana porosa all’interno del chip, creando una barriera endoteliale che simula i capillari fetali. Gli organoidi crescono sopra questa membrana, separati ma in comunicazione con l’endotelio grazie al flusso di nutrienti e fattori secreti che attraversa i pori. Abbiamo chiamato questi nuovi super-organoidi EndTOs (Trophoblast Organoids co-coltivati con Endotelio).

Cosa Abbiamo Scoperto? Risultati Sorprendenti!
I risultati sono stati incredibili! Gli EndTOs, immersi in questa nicchia vascolare dinamica, hanno mostrato:
- Migliore vitalità e crescita a lungo termine: Potevano crescere di più e più a lungo (fino a 12 giorni senza dover essere “ripassati”) rispetto ai TOs coltivati da soli. La morte cellulare era significativamente ridotta.
- Mantenimento della proliferazione e differenziazione: Le cellule trofoblastiche continuavano a proliferare e a differenziarsi correttamente nelle diverse linee cellulari (citotrofoblasti – CTB, sinciziotrofoblasti – STB), mantenendo una buona architettura simile a quella dei villi (anche se con un’organizzazione “inside-out” tipica degli organoidi).
- Produzione di ormoni: Continuavano a secernere hCG (gonadotropina corionica umana), l’ormone della gravidanza.
- Comunicazione bidirezionale: Non solo l’endotelio aiutava gli organoidi, ma anche gli organoidi stimolavano la proliferazione delle cellule endoteliali, suggerendo un dialogo attivo tra i due tipi cellulari, fondamentale per l’angiogenesi (formazione di nuovi vasi) nella placenta. Abbiamo anche visto che gli organoidi secernono fattori che promuovono l’angiogenesi.
Abbiamo anche testato la capacità del sistema di generare organoidi arricchiti in trofoblasti extravillosi (EOs), quelle cellule cruciali che invadono l’utero materno. Togliendo alcuni fattori dal terreno di coltura, abbiamo ottenuto EOs che esprimevano i marcatori giusti (come HLA-G) e producevano enzimi (come MMP-2) associati all’invasione. E indovinate un po’? Anche in questo caso, la co-coltura con l’endotelio (creando gli EndEOs) potenziava la differenziazione verso questo tipo cellulare invasivo!
Un Sistema Immunitario Potenziato
Ma la scoperta forse più entusiasmante riguarda il sistema immunitario innato. Analizzando i geni espressi (con RNA-seq) e le molecole secrete (con analisi del secretoma) dagli EndTOs, abbiamo notato qualcosa di straordinario. Rispetto ai TOs semplici, gli EndTOs mostravano un’attivazione significativa delle vie di segnalazione legate alla risposta immunitaria innata e alla difesa antivirale.
In particolare, producevano livelli molto più alti di interferoni (IFNs) di tipo I (IFN-α2, IFN-β) e di tipo III (IFN-λ1, IFN-λ2), molecole potentissime che sono la prima linea di difesa contro i virus. È come se la presenza della nicchia vascolare “allenasse” le cellule trofoblastiche a essere più pronte e reattive contro potenziali minacce. Secernevano anche altre molecole immunomodulanti importanti per la gravidanza, come la Pentraxina-3 e l’IL-8. Questo suggerisce che l’interazione con l’endotelio è cruciale per potenziare le difese immunitarie intrinseche della placenta.
La Prova del Nove: L’Infezione da Zika Virus
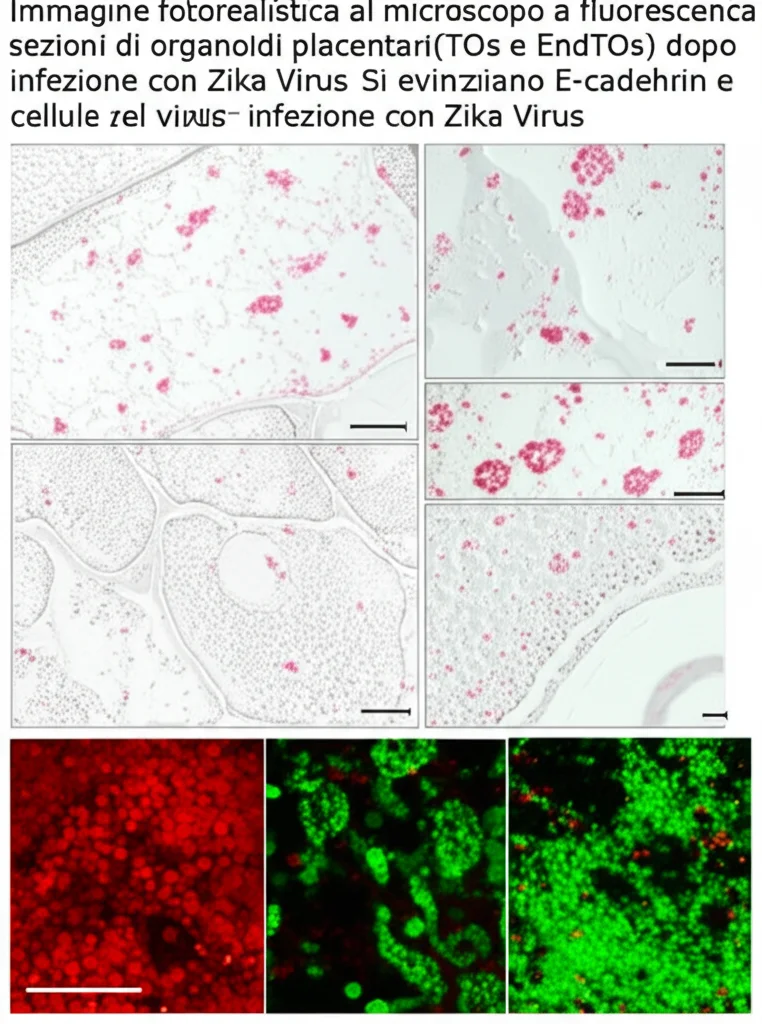
A cosa serve un modello se non lo metti alla prova? Abbiamo deciso di usare il nostro sistema EndTO per studiare l’infezione da Zika Virus (ZIKV), un patogeno noto per poter attraversare la barriera placentare e causare gravi problemi al feto.
Abbiamo infettato sia i TOs semplici che gli EndTOs con ZIKV. I risultati sono stati netti:
- Minore suscettibilità degli EndTOs: Gli EndTOs erano significativamente meno suscettibili all’infezione rispetto ai TOs. Il livello di RNA virale e il numero di cellule infette (marcate con la proteina virale NS2B) erano molto più bassi negli EndTOs.
- Risposta immunitaria robusta: Anche se meno infettati, gli EndTOs rispondevano all’infezione producendo ancora più interferoni (soprattutto IFN-λ1, IFN-λ2 e IFN-β), confermando la loro potenziata capacità di difesa antivirale.
- Trofoblasti come bersaglio primario: L’analisi ha confermato che ZIKV infetta principalmente le cellule trofoblastiche (in particolare i CTB), mentre le cellule endoteliali nella co-coltura risultavano molto meno permissive al virus, suggerendo che i trofoblasti stessi, specialmente nel contesto della nicchia vascolare, agiscono da barriera protettiva.
- Integrità della barriera: L’infezione da ZIKV non sembrava compromettere significativamente l’integrità della barriera endoteliale nel nostro sistema di co-coltura.
Questi risultati evidenziano il ruolo cruciale della nicchia vascolare nel potenziare le difese antivirali innate dei trofoblasti e nel limitare la suscettibilità all’infezione da ZIKV. Il nostro modello ha catturato questa complessa interazione in modo molto più fedele rispetto ai modelli precedenti.
Perché Questo Modello è Importante?
Questo sistema di organoidi placentari ingegnerizzati in una nicchia vascolare su chip rappresenta un passo avanti significativo. Ci offre una piattaforma più realistica e robusta per:
- Studiare lo sviluppo della placenta umana nelle prime fasi.
- Capire le complesse interazioni tra trofoblasti e cellule endoteliali fetali.
- Indagare i meccanismi di difesa immunitaria innata della placenta.
- Modellare le infezioni congenite (come Zika, ma potenzialmente anche altre) e capire come i patogeni attraversano (o vengono bloccati da) la barriera placentare.
- Testare potenziali farmaci o terapie per prevenire complicazioni della gravidanza o infezioni verticali in un contesto fisiologicamente più rilevante.
Certo, c’è ancora spazio per migliorare. Ad esempio, potremmo integrare altre cellule importanti presenti nella placenta, come le cellule immunitarie (macrofagi fetali o cellule NK uterine). Potremmo anche collegare questo chip ad altri “organ-on-a-chip” (come un chip endometriale) per studiare interazioni più sistemiche, come l’impianto.
Ma la strada è tracciata. Combinando biologia delle cellule staminali, ingegneria tissutale e microfluidica, stiamo aprendo nuove finestre sulla biologia della riproduzione umana e sulle malattie che possono colpire mamma e bambino durante la gravidanza. È un campo di ricerca incredibilmente dinamico e promettente, e sono entusiasta di vedere dove ci porterà!
Fonte: Springer