Arterie di Pietra? No Grazie! Vi Racconto Come Stiamo Rivoluzionando l’Aterectomia Coronarica
Ciao a tutti! Oggi voglio parlarvi di un argomento che mi sta particolarmente a cuore, perché tocca la salute di tantissime persone e rappresenta una di quelle sfide mediche che, quando si riesce a superare, ti dà una soddisfazione immensa. Parliamo di arterie coronarie, quei tubicini vitali che portano sangue al nostro muscolo cardiaco, e di quando, ahimè, si “incrostano” seriamente.
Il Problema: Quando le Arterie Diventano Roccia
Avete presente l’aterosclerosi? È quella subdola malattia in cui colesterolo e altre sostanze grasse si accumulano progressivamente nelle arterie, formando delle placche. Col tempo, queste placche possono diventare dure come la pietra, calcificandosi. Immaginatevi un tubo che piano piano si ostruisce con del calcare: il flusso sanguigno si riduce, e questo può portare a eventi cardiovascolari avversi maggiori (i cosiddetti MACE), come infarti o ictus. Un bel problema, vero?
Per le placche più “morbide” e agli stadi iniziali, l’angioplastica con impianto di stent (PCI) è spesso la soluzione: si inserisce un palloncino, si dilata l’arteria e si posiziona una piccola retina metallica (lo stent) per mantenerla aperta. Ma quando la calcificazione è severa, dura, quasi ossea, il palloncino da solo non basta. È qui che entra in gioco una tecnica più “tosta”: l’aterectomia rotazionale (AR).
Aterectomia Rotazionale: Un Bisturi ad Alta Velocità
L’AR è una procedura interventistica affascinante: si utilizza un catetere con in punta una piccola fresa diamantata (il “burr”) che ruota a velocità elevatissime, parliamo di 80.000-170.000 giri al minuto! Questa fresa polverizza letteralmente il tessuto calcificato, allargando il lume del vaso e permettendo poi, se necessario, un impianto di stent più efficace. Pensate che l’AR ha tassi di successo procedurale molto alti, specialmente in lesioni cronicamente ostruite e severamente calcificate. Sembra fantascienza, ma è realtà!
Studi precedenti hanno mostrato tassi di pervietà primaria con AR che possono raggiungere il 99% nei primi 12 mesi post-intervento e l’83% a 24 mesi. Insomma, una tecnica davvero potente.
La Sfida: Evitare Danni Collaterali
Come ogni procedura potente, anche l’AR non è priva di rischi. L’inserimento di strumenti nel corpo è sempre delicato. Forze eccessive durante la fresatura, il calore generato dall’attrito e i detriti prodotti possono portare a complicazioni serie: rottura o dissezione del vaso, fenomeno di “no-reflow” (il sangue non riesce a scorrere bene a valle nonostante la disostruzione) o formazione di trombi. Capite bene che minimizzare questi rischi è cruciale.
Per esempio, forze eccessive possono danneggiare l’endotelio vascolare, la parete interna dell’arteria, causando ematomi e dissezioni. Detriti troppo grandi possono ostruire i capillari più piccoli a valle. E un aumento eccessivo della temperatura può favorire l’aggregazione piastrinica e la formazione di trombi. Ecco perché la ricerca si concentra tantissimo sull’ottimizzazione dei parametri e degli strumenti dell’AR.
La Nostra Proposta: Un Nuovo Strumento e un Modello Virtuale
Ed è qui che entro in gioco io, o meglio, il team di ricerca con cui ho avuto il piacere di collaborare per questo studio. Per cercare di mitigare proprio questi problemi di forza e calore eccessivi, abbiamo progettato e realizzato un nuovo strumento di taglio ad alte prestazioni specificamente pensato per la rimozione del tessuto calcificato nelle coronarie. Ma non ci siamo fermati qui: abbiamo anche sviluppato un modello di simulazione dell’AR. Perché? Perché le simulazioni ci permettono di “vedere” cosa succede a livello microscopico, di testare virtualmente diverse condizioni e di ottimizzare il design e i parametri prima ancora di passare agli esperimenti reali. È un po’ come avere una sfera di cristallo hi-tech!
Il nostro obiettivo era chiaro: studiare a fondo il meccanismo dell’AR e le sue caratteristiche di processamento, integrando analisi di simulazione ed esperimenti per capire come i parametri influenzano i risultati. Abbiamo costruito una piattaforma sperimentale ad hoc e proposto questo nuovo strumento di taglio.
Dentro il Laboratorio: Simulazioni ed Esperimenti
Per i nostri test, abbiamo usato sia osso bovino fresco (che ha proprietà meccaniche simili al tessuto umano calcificato) sia campioni di tessuto calcificato umano ottenuti, con tutti i consensi e le approvazioni etiche del caso, dal Fujian Medical University Union Hospital. L’osso bovino è stato lavorato per creare dei cilindri con un foro interno, simulando un vaso sanguigno. Questi modelli sono stati poi incapsulati in resina.
Il nostro nuovo strumento, realizzato in acciaio inossidabile 316L tramite stampa 3D metallica di precisione, ha una forma ellittica per minimizzare l’attrito e la resistenza del fluido. La parte frontale è ricoperta da scanalature semicircolari che agiscono come micro-bordi taglienti, migliorando la rimozione del materiale. Ne abbiamo realizzati di quattro dimensioni comunemente usate (1.25 mm, 1.5 mm, 1.75 mm, 2.0 mm).
Durante gli esperimenti, abbiamo misurato le forze di taglio con sensori piezoelettrici ad alta precisione, la temperatura con termocoppie, e abbiamo anche analizzato la traiettoria di movimento dello strumento con una telecamera ad alta velocità. Per le simulazioni, abbiamo usato il software ABAQUS, creando modelli 3D e 2D micro-scalari per studiare dalla forza macroscopica alla formazione microscopica dei detriti.

Come si Muove questo Strumento Magico?
Una delle scoperte più interessanti riguarda il movimento dello strumento. Non ruota semplicemente sul suo asse, ma compie anche un movimento orbitale lungo la parete del vaso. Questo succede perché l’asse di rotazione si flette leggermente sotto la coppia sbilanciata, creando una sorta di “mulinello”. Abbiamo descritto questo pattern come “collisione-rimbalzo-ricollisione“: lo strumento tocca intermittentemente il tessuto calcificato, lo rimuove, si stacca e poi tocca di nuovo. Questo contatto intermittente è fondamentale.
Abbiamo anche analizzato la pressione idrodinamica del film di sangue che si forma tra lo strumento e la parete vascolare. È emerso che quando lo strumento è a contatto con il tessuto calcificato, lo spessore del film è piccolissimo (circa 0.025 µm), permettendo una rimozione efficace. Quando invece è vicino alla parete sana del vaso, lo spessore del film è maggiore (circa 10.8 µm), agendo come una barriera protettiva e prevenendo danni. Geniale, no?
Forza, Temperatura e Detriti: I Risultati Sotto la Lente
E veniamo ai risultati, la parte più succosa! Le simulazioni e gli esperimenti hanno mostrato che le forze di taglio, l’aumento di temperatura e la dimensione dei detriti rimanevano entro soglie di sicurezza predefinite. Prendiamo ad esempio lo strumento da 1.5 mm: la forza di taglio di picco è stata di 1.062 N (simulata) e l’aumento di temperatura massimo ha raggiunto 1.170 °C (simulato). Valori ben al di sotto dei limiti considerati pericolosi (ad esempio, il limite medico per la forza è 5N e per l’aumento di temperatura è 6°C nei tessuti umani).
Abbiamo osservato che:
- Aumentando le dimensioni dello strumento e la velocità di rotazione, aumentano sia la forza di taglio che la temperatura. Ad esempio, con lo strumento da 2.0 mm a 120.000 rpm, la forza massima simulata è stata di 1.062 N e quella sperimentale di 0.987 N. L’aumento di temperatura massimo misurato è stato di 1.17°C e 1.15°C rispettivamente.
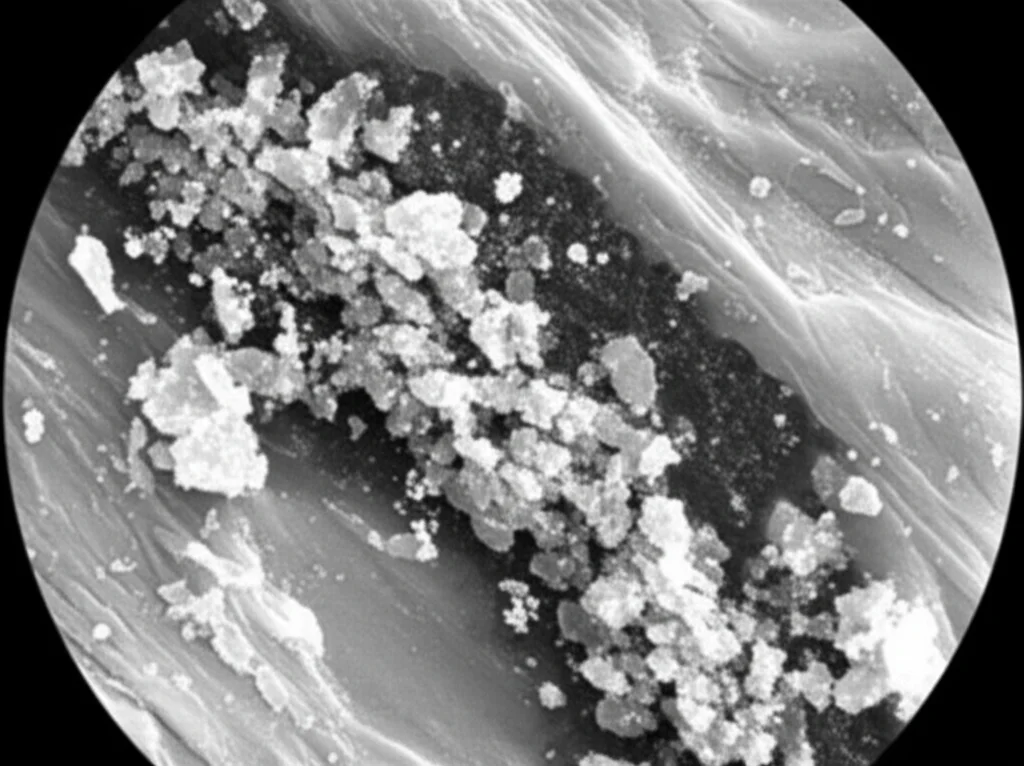
- La dimensione dei detriti ha mostrato un andamento interessante: aumentando la velocità di rotazione, la dimensione media dei detriti diminuiva. Questo è positivo, perché detriti più piccoli sono meno problematici. Con lo strumento da 1.5 mm, simulando il taglio dell’osso, la dimensione dei detriti variava da 14 µm a 8.5 µm; per il tessuto calcificato, da 12.8 µm a 7.2 µm. Tutti valori significativamente inferiori alla soglia di sicurezza clinica.
- Al contrario, aumentando le dimensioni dello strumento, la dimensione dei detriti tendeva ad aumentare.
Un dato cruciale è che il 90% delle particelle di detriti misurava meno di 14 µm. Questo è un ottimo risultato!
Simulazione vs. Realtà: Un Modello Affidabile
Una delle soddisfazioni più grandi è stata vedere quanto i risultati sperimentali fossero vicini a quelli della simulazione. Gli errori erano inferiori al 10% per la maggior parte dei parametri, confermando la precisione del nostro modello di simulazione. Questo è importantissimo, perché un modello affidabile ci permette di esplorare scenari complessi e ottimizzare ulteriormente la procedura con costi e tempi ridotti.
Cosa Significa Tutto Questo per i Pazienti?
Beh, significa che stiamo facendo passi da gigante per rendere l’aterectomia rotazionale ancora più sicura ed efficace. Un nuovo strumento come quello che abbiamo studiato, capace di controllare meglio forza, temperatura e dimensione dei detriti, si traduce in un minor rischio di complicazioni per i pazienti. E una migliore comprensione del meccanismo dell’AR aiuta i medici a scegliere i parametri ottimali per ogni singolo caso.
Questo studio fornisce un supporto teorico importante e contribuisce a ottimizzare l’efficacia dell’AR. Il nostro nuovo strumento ha dimostrato prestazioni eccellenti nel sopprimere forza, temperatura e dimensione dei frammenti, offrendo una nuova prospettiva per migliorare gli effetti terapeutici dell’AR.

Guardando al Futuro: Prossimi Passi
Certo, la ricerca non si ferma mai. Il nostro studio ha alcune limitazioni: ad esempio, la simulazione non ha considerato appieno gli effetti dei liquidi, e l’ambiente sperimentale, per quanto accurato, non è identico all’ambiente del corpo umano. Quindi, il lavoro futuro includerà sicuramente esperimenti sull’uomo e la valutazione dell’integrazione di metodi di processamento avanzati, presi magari da pratiche ingegneristiche, come l’assistenza vibratoria, per migliorare ulteriormente gli effetti terapeutici dell’AR e renderla sempre più diffusa e sicura.
Spero di avervi trasmesso un po’ della passione che c’è dietro a questo tipo di ricerca. L’obiettivo è sempre lo stesso: migliorare la vita delle persone, un’arteria alla volta!
Fonte: Springer