Cancro, abbiamo una nuova freccia al nostro arco? Scopriamo gli inibitori della chinasi ERK5!
Ciao a tutti! Oggi voglio parlarvi di qualcosa di veramente affascinante che sta succedendo nel mondo della ricerca sul cancro. Come sapete, la lotta contro questa malattia è una delle sfide più grandi della nostra epoca, e noi ricercatori siamo costantemente alla ricerca di nuove strategie, nuove “armi” per combatterla in modo più efficace e mirato.
Un bersaglio promettente: la chinasi ERK5
Nel mirino della ricerca più recente c’è una proteina particolare, una chinasi chiamata ERK5. Perché è così interessante? Beh, abbiamo scoperto che ERK5 gioca un ruolo chiave, quasi da protagonista, nella crescita e nella sopravvivenza delle cellule tumorali in diversi tipi di cancro. Immaginatela come un interruttore che, se acceso, dice alle cellule tumorali: “Crescete! Moltiplicatevi! Sopravvivete!”. È coinvolta in processi fondamentali come la proliferazione, la migrazione (cioè la capacità delle cellule di spostarsi e formare metastasi) e persino la differenziazione cellulare.
Ovviamente, se ERK5 è così importante per il tumore, bloccarla sembra una strategia logica, no? Spegnere quell’interruttore potrebbe rallentare o fermare la crescita del cancro. E infatti, l’idea di usare inibitori di ERK5 come terapia antitumorale è diventata molto promettente.
I limiti degli inibitori attuali e la nostra sfida
Esistono già alcuni inibitori di ERK5, come il famoso XMD8-92, che hanno mostrato proprietà antitumorali, specialmente contro il cancro ai polmoni e alla cervice. Però, come spesso accade in medicina, le cose non sono così semplici. Questi primi inibitori hanno mostrato alcuni problemi:
- Effetti collaterali imprevisti (off-target effects): colpiscono anche altre proteine oltre a ERK5.
- Attivazione paradossa: a volte, invece di spegnere, finiscono per attivare altre vie di segnalazione pericolose per la cellula.
Questi limiti ne hanno frenato l’uso clinico. Ed è qui che entriamo in gioco noi! La sfida era chiara: sviluppare nuovi inibitori di ERK5 che fossero più selettivi, più efficaci e con meno effetti collaterali. Volevamo creare molecole “intelligenti”, capaci di colpire solo ERK5 senza fare danni altrove.
Nascono i NAIMS: nuove molecole all’orizzonte
Ci siamo ispirati a una classe di composti chiamati derivati azolici (come l’imidazolo), noti per la loro capacità di interagire bene con enzimi e recettori nel corpo. Abbiamo pensato: e se combinassimo un anello imidazolico con un’altra struttura, quella del naftalene (già studiata in passato per altre attività farmacologiche)? L’idea era che questa combinazione potesse potenziare l’effetto antitumorale e migliorare la specificità per ERK5.
Così, abbiamo progettato e sintetizzato in laboratorio una nuova serie di composti, che abbiamo chiamato NAIMS (acronimo che sta per 1,4-dialkoxynaphthalene-imidazolium salt derivatives). Abbiamo creato diverse varianti di queste molecole, modificando piccole parti della loro struttura per capire quali fossero le più efficaci. Era un po’ come creare tante chiavi diverse per vedere quale aprisse meglio la “serratura” ERK5.

Dalla teoria alla pratica: testiamo i NAIMS
Una volta create le nostre molecole, dovevamo capire se funzionavano davvero. Abbiamo usato un approccio combinato:
- Modellazione molecolare: Prima ancora di andare in laboratorio, abbiamo usato potenti computer per simulare come i nostri NAIMS si legassero alla proteina ERK5. Questo ci ha dato una prima idea di quali molecole avessero il potenziale migliore, un po’ come provare una chiave virtuale in una serratura virtuale. Abbiamo calcolato l’affinità di legame e analizzato le interazioni specifiche.
- Test in vitro (sulle cellule): Abbiamo poi preso le molecole più promettenti secondo i computer e le abbiamo testate su cellule tumorali umane (in questo caso, cellule HeLa, derivate da un tumore della cervice).
- Test di vitalità (MTT assay): Abbiamo misurato quanto fossero tossici i nostri composti per le cellule tumorali, calcolando l’IC50 (la concentrazione necessaria per uccidere il 50% delle cellule). Più basso è l’IC50, più potente è il composto.
- Espressione di PCNA: Abbiamo controllato i livelli di una proteina chiamata PCNA, che è un marcatore della proliferazione cellulare. Se un composto riduce PCNA, significa che sta rallentando la crescita tumorale. Abbiamo usato la tecnica qRT-PCR per misurare l’mRNA di PCNA.
- Test sull’attività chinasica: Fondamentale! Abbiamo verificato se i nostri NAIMS bloccassero specificamente l’attività enzimatica di ERK5 (usando un test chiamato Z’-LYTE™ Kinase Assay) e se, importantissimo, *non* bloccassero altre chinasi simili come ERK1/2, per evitare gli effetti collaterali visti con i vecchi inibitori.
- Test del reporter AP-1: ERK5 controlla l’espressione di altri geni tramite fattori come AP-1. Abbiamo verificato se i nostri composti riducessero l’attività di AP-1, confermando l’inibizione di ERK5 all’interno delle cellule.
- Induzione di apoptosi (morte cellulare programmata): Volevamo vedere se i NAIMS spingessero le cellule tumorali al “suicidio” programmato (apoptosi). Abbiamo usato la colorazione DAPI per osservare i cambiamenti nel nucleo delle cellule e la citometria a flusso (con colorazione Annexin V/PI) per quantificare le cellule in apoptosi.
- Analisi del ciclo cellulare: Abbiamo controllato se i composti bloccassero il ciclo di divisione cellulare, magari in una fase specifica (come la fase G2/M), usando la citometria a flusso.
I campioni emergono: 4c, 4e e 4k
Dai nostri test su 21 composti NAIMS sintetizzati, tre si sono distinti particolarmente: li abbiamo chiamati 4c, 4e e 4k. Questi tre “campioni” hanno mostrato:
- Valori di IC50 promettenti (tra 5.7 e 8.9 µM), indicando una buona potenza contro le cellule HeLa.
- Una significativa capacità di ridurre l’espressione di PCNA (dal 50% fino al 70.2% di inibizione a 5 µM), suggerendo un forte effetto antiproliferativo.
Questi risultati ci hanno spinto a studiarli ancora più a fondo.
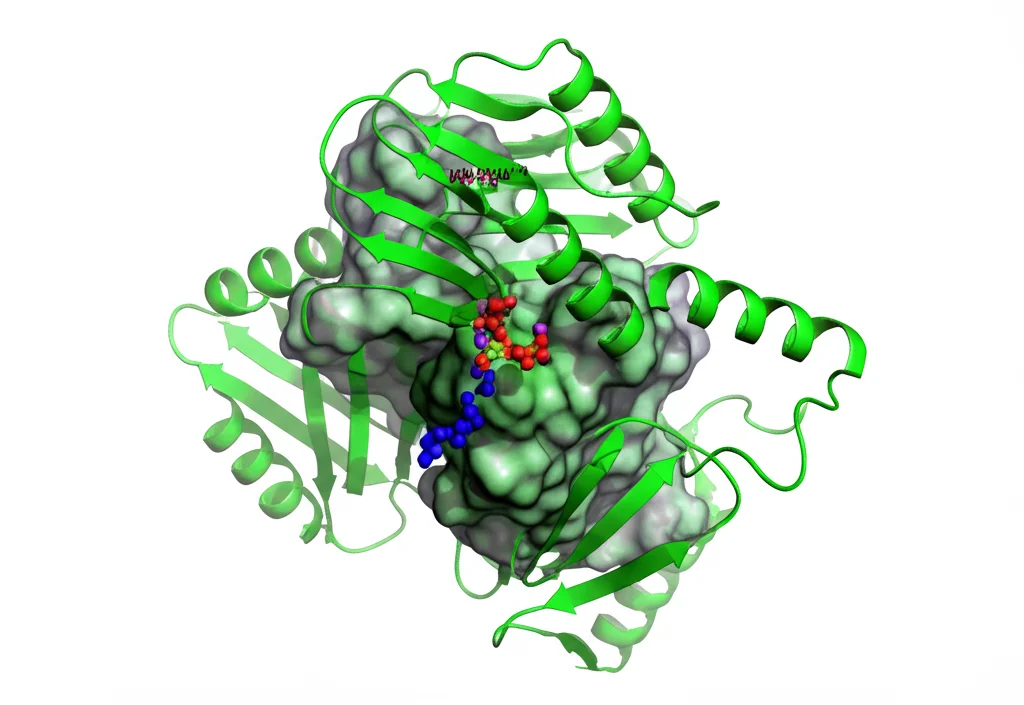
Il protagonista: il composto 4e
Tra i tre finalisti, il composto 4e è emerso come particolarmente interessante. Ecco perché:
- Inibizione specifica di ERK5: I test sull’attività chinasica hanno confermato che 4e (con un IC50 di 5.1 µM contro ERK5) inibisce efficacemente ERK5, ma, cosa cruciale, non inibisce ERK1/2. Questa selettività è un vantaggio enorme rispetto ai vecchi inibitori!
- Conferma dell’inibizione in cellula: 4e ha ridotto significativamente l’espressione del reporter AP-1, confermando che blocca l’attività di ERK5 anche all’interno dell’ambiente cellulare complesso.
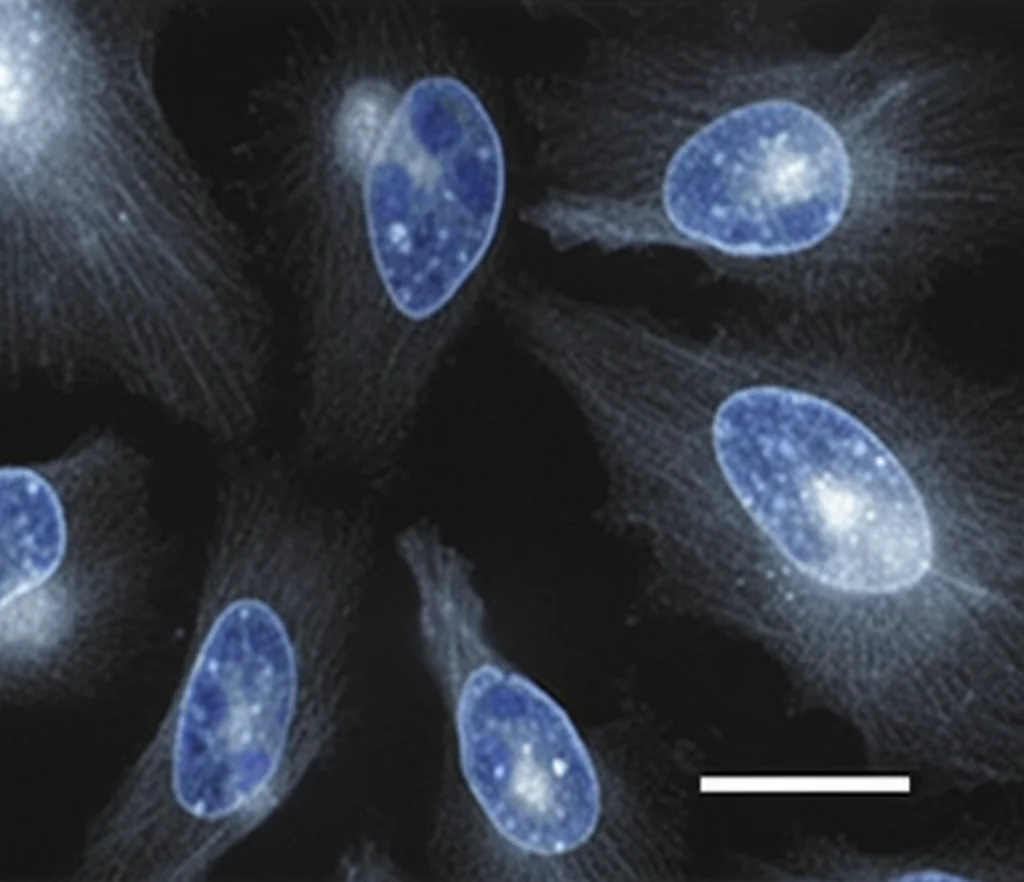
- Induzione di apoptosi: La colorazione DAPI e la citometria a flusso hanno mostrato che 4e induce le cellule HeLa ad entrare in apoptosi tardiva, spingendole verso la morte programmata.
- Arresto del ciclo cellulare: 4e ha causato un accumulo di cellule nella fase G2/M del ciclo cellulare, impedendo loro di completare la divisione.
- Ottimo “fit” molecolare: La modellazione molecolare ha rivelato che 4e si lega in modo forte e stabile al sito di legame dell’ATP di ERK5. La sua struttura unica, con un gruppo isopropilico sull’anello benzimidazolico, sembra creare interazioni particolarmente favorevoli (come interazioni alchil-π e π-π) che stabilizzano il legame, spiegando la sua potente attività.
- Potenziale selettività (predizione computazionale): Usando strumenti computazionali come SwissTargetPrediction, abbiamo previsto che 4e ha una bassa probabilità di interagire con altre chinasi importanti (come MAPK11, ERK2, BRAF), suggerendo un’alta selettività per ERK5. Ovviamente, questo andrà confermato sperimentalmente, ma è un segnale molto incoraggiante.
Cosa significa tutto questo?
I nostri risultati suggeriscono fortemente che i composti NAIMS, e in particolare il nostro “campione” 4e, sono candidati molto promettenti come nuovi inibitori selettivi di ERK5. Hanno dimostrato di poter bloccare l’attività di ERK5, rallentare la crescita delle cellule tumorali, indurre la loro morte e bloccare la loro divisione, il tutto con una potenziale maggiore selettività rispetto agli inibitori precedenti.
Questo apre la strada allo sviluppo di nuove terapie antitumorali mirate. Certo, la strada è ancora lunga: questi sono risultati preliminari, e serviranno molti altri studi (preclinici e poi clinici) per confermare l’efficacia e la sicurezza di queste molecole nell’uomo. Ma aver identificato una nuova classe di composti con queste caratteristiche è un passo avanti importante.
Il composto 4e, in particolare, si presenta come un eccellente “lead compound”, cioè un punto di partenza per progettare farmaci ancora migliori. È una nuova speranza, una nuova potenziale arma nella nostra battaglia contro il cancro. E noi siamo entusiasti di continuare a lavorare in questa direzione!
Fonte: Springer







