NRF1: Il Guardiano Segreto che Ci Difende da un Pericolo Nascosto nelle Nostre Cellule
Ciao a tutti! Oggi voglio portarvi con me in un viaggio affascinante nel cuore delle nostre cellule, un posto incredibilmente complesso e pieno di sorprese. Parleremo di molecole vitali, di equilibri delicati e di come un meccanismo di difesa naturale ci protegga da una sostanza davvero insidiosa prodotta proprio da noi. Sembra un film di spionaggio, vero? E in un certo senso, lo è!
Le Poliammine: Amiche Essenziali, Ma Occhio all’Equilibrio!
Avete mai sentito parlare delle poliammine? Sono piccole molecole organiche – nomi come putrescina, spermidina e spermina potrebbero suonarvi familiari se siete appassionati di biochimica – e sono incredibilmente abbondanti nelle nostre cellule. Pensate che le loro concentrazioni si misurano in millimoli (mM), un’enormità a livello cellulare! Sono fondamentali per un sacco di cose:
- Sintesi di proteine e acidi nucleici (DNA e RNA).
- Stabilizzazione del nostro prezioso materiale genetico.
- Corretta divisione cellulare (mitosi).
In condizioni normali, le cellule mantengono un rapporto costante tra queste tre molecole principali attraverso complessi percorsi di sintesi (anabolismo) e degradazione (catabolismo). Un equilibrio perfetto, orchestrato da enzimi specifici.
Il Lato Oscuro del Metabolismo: Quando le Poliammine Diventano un Problema
Ma cosa succede quando questo equilibrio si rompe? Stress di vario tipo – come un sovraccarico di poliammine, stress ossidativo, invecchiamento o infezioni – possono far pendere la bilancia verso la degradazione. In particolare, un enzima chiamato spermina ossidasi (SMOX) entra in gioco in modo preponderante. SMOX prende la spermina (la poliammina a catena più lunga) e la converte in spermidina. Fin qui, tutto normale, direte voi. Il problema è che questa reazione produce anche due sottoprodotti non proprio simpatici: perossido di idrogeno (H2O2, la comune acqua ossigenata, un noto agente ossidante) e 3-aminopropanale.
Ed è qui che le cose si fanno serie. Il 3-aminopropanale reagisce spontaneamente (senza bisogno di altri enzimi) con l’H2O2 per formare una molecola chiamata acroleina. Segnatevi questo nome, perché è il vero “cattivo” della nostra storia.
Acroleina: Un Vandalo Molecolare Mille Volte Peggiore dei ROS
L’acroleina è l’aldeide insatura più semplice che esista, ma la sua semplicità nasconde una pericolosità estrema. È talmente reattiva che per molto tempo la sua esistenza stessa all’interno delle cellule è stata quasi ignorata, perché reagisce quasi istantaneamente con tutto quello che trova:
- Il nostro DNA, causando danni genetici.
- Le proteine, alterandone la struttura e la funzione (denaturazione).
- I lipidi, compromettendo le membrane cellulari.
Pensate che il suo potenziale di danno è considerato 1000 volte superiore a quello delle specie reattive dell’ossigeno (ROS), come l’H2O2! Un aumento locale di acroleina può avere effetti devastanti. Le macromolecole “coniugate” all’acroleina (che chiameremo AcPro, da Acrolein-conjugated Proteins) portano a instabilità proteica, disfunzione dei mitocondri (le centrali energetiche della cellula) e rottura delle membrane. Capite bene che tenere a bada la produzione di acroleina è cruciale per prevenire malattie e mantenere le nostre cellule sane.
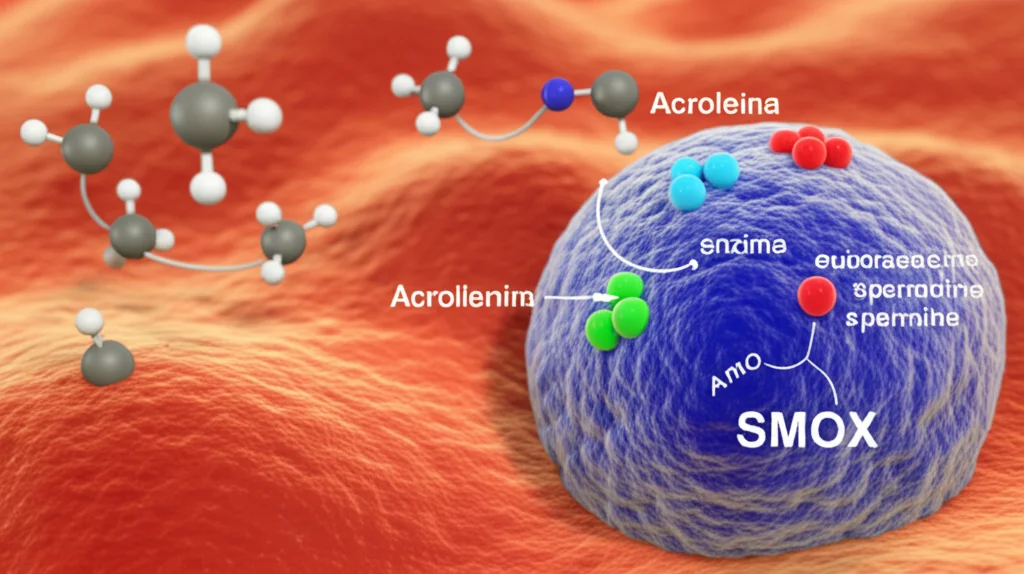
Curiosamente, con l’invecchiamento, la quantità totale di poliammine tende a diminuire, e questo calo è oggi visto come un fattore di rischio per malattie legate all’età, come quelle neurodegenerative e l’ictus. Per questo si cerca di mantenere alti i livelli di poliammine con la dieta (cibi ricchi come il nattō, l’avena) o addirittura trapianti di microbiota intestinale. Ma approcci farmacologici mirati sono ancora rari. Ed è qui che entra in scena il nostro eroe…
NRF1: Il Fattore di Trascrizione che Mette il Freno a SMOX
Nel nostro laboratorio (uso il “noi” per coinvolgervi, ma mi riferisco al team di ricerca dello studio originale!), abbiamo scoperto che un attore chiave in tutta questa vicenda è un fattore di trascrizione chiamato NRF1 (NF-E2-related factor 1). I fattori di trascrizione sono come dei “registi” genetici: dicono ai geni quando e quanto devono essere attivi. NRF1 normalmente se ne sta ancorato alla membrana del reticolo endoplasmatico, ma in certe condizioni si sposta nel nucleo e attiva geni che aiutano la cellula a gestire lo stress, specialmente quello legato a proteine mal ripiegate e all’equilibrio degli antiossidanti.
Sappiamo che NRF1 è fondamentale: topi in cui viene eliminato NRF1 in specifici tessuti (fegato, neuroni, tessuto adiposo bruno) sviluppano gravi problemi come osteoporosi, fegato grasso (steatosi epatica non alcolica, NAFLD), cancro, diabete e malattie neurodegenerative. Ma qual è la molecola chiave la cui alterazione, in assenza di NRF1, scatena questi disastri?
L’Indagine nel Fegato: Cosa Succede Quando Manca NRF1?
Per capirlo meglio, abbiamo utilizzato un modello di topo molto sofisticato, in cui potevamo “spegnere” il gene Nrf1 specificamente nel fegato e solo quando volevamo noi, usando un induttore chimico (il 3-metilcolantrene, 3MC). Questi topi, che chiamiamo N1KO (Nrf1 Knockout), hanno sviluppato proprio i sintomi che ci aspettavamo, simili alla NAFLD, con epatociti “gonfi” e morte cellulare (apoptosi).
Analizzando nel dettaglio le molecole presenti nel fegato di questi topi N1KO e confrontandoli con topi di controllo, abbiamo fatto una scoperta cruciale riguardante proprio le poliammine:
- I livelli di spermina (Spm) erano diminuiti.
- I livelli di putrescina (Put) e spermidina (Spd) erano aumentati.
Questo indicava chiaramente che la via metabolica che degrada la spermina in spermidina era accelerata. E chi è il principale responsabile di questa via? Esatto, l’enzima SMOX!
Andando a misurare l’espressione dei geni e i livelli delle proteine degli enzimi coinvolti, abbiamo avuto la conferma: nei topi N1KO, l’mRNA e la proteina SMOX erano significativamente aumentati, mentre altri enzimi del metabolismo delle poliammine (come PAO e SPMS) erano diminuiti o invariati. Era chiaro: senza NRF1, la cellula produceva molto più SMOX.
La Prova del Nove: Acroleina e Danni Proteici alle Stelle
Se SMOX aumenta, cosa ci aspettiamo di trovare? Esatto, più acroleina e più proteine danneggiate dall’acroleina (AcPro). E infatti, usando anticorpi specifici che riconoscono le proteine modificate dall’acroleina, abbiamo visto un accumulo massiccio di AcPro nel fegato dei topi N1KO (circa 1.8 volte di più rispetto ai controlli). Non solo: usando una sonda fluorescente che si illumina in presenza di acroleina libera (AcroleinRED), abbiamo visualizzato direttamente un aumento di circa due volte dell’acroleina libera nel tessuto epatico dei topi N1KO. Il quadro era completo: la mancanza di NRF1 portava a un eccesso di SMOX, che a sua volta causava un accumulo pericoloso di acroleina e danni alle proteine.
NRF1 Agisce Direttamente sul Gene SMOX
Ma NRF1 controlla SMOX direttamente o è un effetto indiretto? Per rispondere, abbiamo usato due tecniche potenti: la ChIP (immunoprecipitazione della cromatina) e i saggi con geni reporter. Con la ChIP, siamo andati a “pescare” i frammenti di DNA a cui NRF1 si lega nel fegato dei topi. Analizzando la regione del gene Smox, abbiamo trovato un sito specifico (che abbiamo chiamato sito 3) a monte del gene, a cui NRF1 si lega in condizioni normali. Questo suggerisce fortemente che NRF1 si posizioni lì per “silenziare” o, meglio, per sopprimere l’espressione di Smox.
Per confermarlo, abbiamo costruito dei “geni reporter”: abbiamo preso quel pezzo di DNA del promotore di Smox (contenente il sito 3) e l’abbiamo collegato a un gene che produce luce (luciferasi). Inserendo questo costrutto in cellule epatiche in coltura, abbiamo visto che la produzione di luce (cioè l’attività del promotore di Smox) aumentava significativamente quando abbassavamo i livelli di NRF1 nelle cellule (usando una tecnica chiamata shRNA). Bingo! NRF1 agisce direttamente come un repressore del gene Smox.
Abbiamo anche controllato se NRF1 regolasse direttamente altri geni del metabolismo delle poliammine (Spms e Pao), ma la ChIP ha mostrato che NRF1 non si lega ai loro promotori. Quindi, l’effetto principale di NRF1 in questo contesto è proprio la soppressione mirata di SMOX.
Conferme in Laboratorio: Manipolare SMOX Cambia i Livelli di Acroleina
Per essere ancora più sicuri, abbiamo fatto altri esperimenti in cellule coltivate in laboratorio:
- Abbiamo “spento” NRF1 in cellule epatiche (Hepa1c1c7) e abbiamo visto, come nei topi, un aumento di SMOX e di acroleina libera.
- Abbiamo preso altre cellule epatiche umane (HuH-7) e abbiamo fatto loro produrre artificialmente tanto SMOX (sovraespressione). Risultato: aumento dose-dipendente di acroleina libera e di proteine danneggiate (AcPro).
- Infine, abbiamo preso cellule di fibroblasti di topo (MEF), sia normali (WT) che prive di NRF1 (N1KO-MEF), e abbiamo ridotto i livelli di SMOX usando siRNA (piccoli RNA interferenti). Risultato: in entrambi i tipi di cellule, abbassare SMOX riduceva significativamente l’acroleina libera. Nelle cellule normali, anche le AcPro diminuivano. Nelle cellule N1KO-MEF, la riduzione di AcPro era meno marcata, forse perché senza NRF1 anche i sistemi di “pulizia” cellulare che eliminano le proteine danneggiate (come il proteasoma, la cui funzione dipende anche da NRF1) funzionano meno bene.
Tutti questi esperimenti convergono sulla stessa conclusione: NRF1 normalmente tiene a bada SMOX. Quando NRF1 cala, SMOX aumenta, il metabolismo delle poliammine si sbilancia verso la degradazione, e la produzione della tossica acroleina va fuori controllo.
Implicazioni e Prospettive Future: Perché Questa Scoperta è Importante?
Questa ricerca svela un meccanismo di difesa cellulare prima sconosciuto. NRF1 non è solo un regolatore dello stress ossidativo o proteico, ma anche un guardiano contro la produzione endogena di acroleina, un agente tossico potentissimo che finora era considerato principalmente un pericolo esterno (fumo di sigaretta, cibi fritti, inquinamento). Invece, le nostre stesse cellule possono produrla in quantità dannose se l’equilibrio metabolico viene perturbato, come accade quando NRF1 è deficitario.
Questo getta nuova luce su molte malattie associate alla perdita di funzione di NRF1, come la NAFLD, le malattie neurodegenerative e forse anche alcuni aspetti dell’invecchiamento, dove l’accumulo di danni da acroleina potrebbe giocare un ruolo significativo.
La buona notizia? Se SMOX è il colpevole diretto dell’aumento di acroleina in queste condizioni, allora bloccare SMOX potrebbe essere una strategia terapeutica promettente. Esistono già alcuni inibitori (come MDL72527), anche se non perfettamente specifici per SMOX. Sviluppare piccole molecole che inibiscano SMOX in modo mirato potrebbe aprire nuove strade per prevenire o trattare i danni cellulari causati dall’acroleina endogena in diverse patologie.
Insomma, abbiamo scoperto che NRF1 è un vero e proprio “soppressore” di SMOX, essenziale per mantenere l’equilibrio delle poliammine e limitare la produzione di un pericoloso “vandalo” molecolare interno. Una storia affascinante che ci ricorda quanto siano complessi e meravigliosamente regolati i meccanismi che ci tengono in vita e in salute!
Fonte: Springer