Linfonodi Infiammati: Un Ruolo Inaspettato per i Neutrofili nell’Artrite
Ciao a tutti! Oggi voglio portarvi con me in un viaggio affascinante nel cuore del nostro sistema immunitario, più precisamente nei linfonodi, quelle piccole “stazioni di controllo” sparse per il corpo. Ci concentreremo su cosa succede lì dentro quando si soffre di artrite infiammatoria (IA), un gruppo di malattie che colpiscono le articolazioni, come l’artrite reumatoide (RA) o l’artrite psoriasica (PsA).
Per anni, noi ricercatori abbiamo studiato i linfonodi, soprattutto nei pazienti con artrite reumatoide positiva agli anticorpi anti-proteine citrullinate (ACPA-positiva). Abbiamo visto cambiamenti importanti nelle cellule dell’immunità adattativa, quelle che imparano a riconoscere nemici specifici, come linfociti B e T. Ma una domanda mi frullava in testa: cosa succede nei pazienti con artrite infiammatoria che *non* hanno questi anticorpi (ACPA-negativi), come quelli con PsA o RA ACPA-negativa? Sono uguali o c’è qualcosa di diverso?
Un’indagine nel Profondo dei Linfonodi
Per rispondere a questa domanda, abbiamo deciso di “sbirciare” direttamente dentro i linfonodi. Grazie a biopsie guidate da ecografia, abbiamo raccolto piccoli campioni di tessuto linfonodale inguinale da tre gruppi di persone:
- Controlli sani (HCs): persone senza malattie reumatiche.
- Pazienti con RA ACPA-positiva.
- Pazienti con IA ACPA-negativa (un gruppo misto che includeva RA ACPA-negativa, PsA, lupus, artropatia da cristalli e artrite indifferenziata).
Abbiamo poi analizzato questi preziosi campioni usando tecniche avanzate come l’analisi del trascrittoma (per vedere quali geni erano “accesi” o “spenti”), la qPCR (per misurare l’espressione di geni specifici) e l’immunoistochimica (per visualizzare direttamente le cellule presenti nel tessuto). L’obiettivo era capire se ci fossero differenze molecolari e cellulari significative tra i gruppi.
Firme Geniche Divergenti: Due Storie Diverse
Ebbene sì, le differenze c’erano, eccome! Analizzando l’espressione genica complessiva, abbiamo scoperto delle “firme” molecolari distinte.
Nei pazienti con RA ACPA-positiva, rispetto ai controlli sani, abbiamo visto un’attivazione maggiore di geni legati proprio all’immunità adattativa. Geni come CD38 (presente su linfociti B e T attivati), IGKC e MZB1 (coinvolti nella produzione di anticorpi), e molecole segnale dei linfociti T come SPP1 e JAK2, oltre a chemochine (richiami per cellule immunitarie) come CCL20 e CCL4. Questo confermava, in un certo senso, quello che già sospettavamo: nei linfonodi di questi pazienti c’è un gran fermento legato alla risposta immunitaria specifica, probabilmente diretta contro le proteine citrullinate. L’analisi dei pathway (insiemi di geni che lavorano insieme) ha mostrato un aumento dell’attività legata al ciclo cellulare e alla replicazione del DNA, suggerendo un ambiente linfonodale molto “attivo”.
Ma la vera sorpresa è arrivata guardando i pazienti con IA ACPA-negativa. Qui la storia era diversa. Rispetto ai controlli sani, questi pazienti mostravano un’attivazione maggiore di geni legati all’immunità innata, la nostra prima linea di difesa, più generica ma rapidissima. In particolare, spiccavano geni come TPSAB1 e CPA3, associati ai mastociti (anche se poi vedremo che i mastociti non sembrano essere i protagonisti principali qui), e soprattutto CTSG (Catepsina G), una proteasi specifica dei neutrofili, e CXCL2, una molecola che attira proprio i neutrofili!

L’analisi dei pathway in questo gruppo ha rivelato un aumento dell’espressione di geni legati all’attività dei lisosomi (le “centrali di smaltimento” delle cellule), molti dei quali sono presenti proprio nei granuli dei neutrofili (come CTSG, CTSC, CTSL1). Addirittura, abbiamo visto attivato un pathway legato alla difesa contro infezioni latenti (come la tubercolosi), che include geni coinvolti nell’attività fagocitaria e antimicrobica tipica dei neutrofili (NCF2, NCF4, CYBA, CYBB, lattoferrina, catelicidina). Insomma, tutti gli indizi puntavano verso una presenza inaspettata e significativa di neutrofili nei linfonodi di questi pazienti.
Conferme e Visualizzazione: I Neutrofili Sotto i Riflettori
Queste scoperte basate sull’analisi genica erano intriganti, ma volevamo conferme più solide. Siamo passati alla qPCR per misurare specificamente i livelli di mRNA di CTSG (il marcatore dei neutrofili) e TPSAB1 (quello dei mastociti).
I risultati? L’espressione di CTSG era significativamente più alta nei linfonodi dei pazienti con IA ACPA-negativa rispetto ai controlli sani. Invece, i livelli di TPSAB1 erano sì un po’ più alti, ma non in modo statisticamente significativo, e comunque molto bassi in generale. Anche l’analisi immunoistochimica per i mastociti ha dato esito negativo. Quindi, abbiamo accantonato l’ipotesi dei mastociti e ci siamo concentrati sui neutrofili.
Abbiamo ripetuto la misurazione di CTSG su un gruppo più ampio di pazienti, suddividendo gli ACPA-negativi in base alla diagnosi specifica (RA ACPA-negativa, PsA, Artrite Indifferenziata). Qui abbiamo visto che l’aumento di CTSG era particolarmente marcato nei pazienti con artrite psoriasica (PsA) rispetto ai controlli.
Ma la prova del nove è arrivata dall’immunoistochimica, usando un anticorpo (anti-CD15) che colora specificamente i neutrofili. Le immagini erano eloquenti: nei linfonodi dei controlli sani, i neutrofili erano praticamente assenti. Al contrario, nei linfonodi dei pazienti con artrite infiammatoria, si vedeva un chiaro afflusso di cellule CD15+!
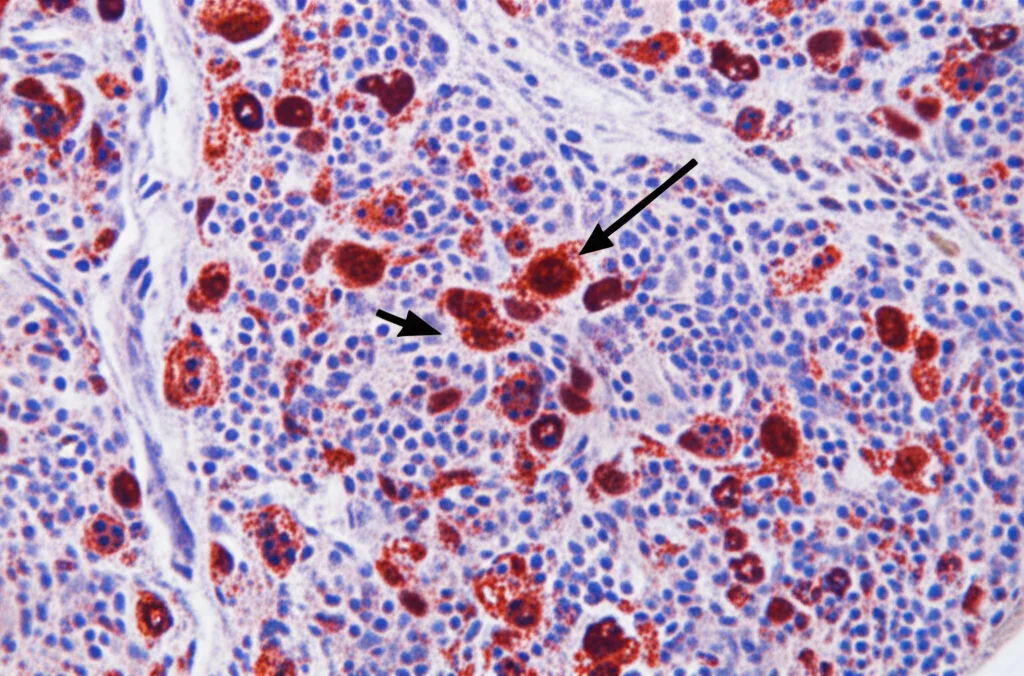
La cosa ancora più interessante è che questa aumentata presenza di neutrofili è stata osservata sia nei pazienti con RA ACPA-positiva sia in quelli con IA ACPA-negativa (in particolare PsA e RA ACPA-negativa), rispetto ai controlli sani. C’era una certa variabilità tra i pazienti – alcuni ne avevano tantissimi, altri meno – ma il trend generale era chiarissimo e statisticamente significativo, specialmente per RA ACPA-positiva e PsA. Questa variabilità non sembrava legata a caratteristiche cliniche specifiche, all’età, al sesso o ai trattamenti in corso.
Un Enigma da Risolvere: Perché i Neutrofili nei Linfonodi?
Trovare neutrofili nei linfonodi in assenza di un’infezione attiva è stata una vera sorpresa! Tradizionalmente, pensiamo ai neutrofili come ai “primi soccorritori” che pattugliano il sangue e accorrono rapidamente nei tessuti in caso di infezione o danno. Sappiamo che possono raggiungere i linfonodi drenanti *durante* un’infezione per aiutare ad attivare la risposta immunitaria, ma la loro presenza in linfonodi “sani” o cronicamente infiammati (ma non infetti) è poco conosciuta.
Studi recenti su modelli animali e anche sull’uomo suggeriscono che forse esiste una piccola popolazione “residente” di neutrofili nei linfonodi anche in condizioni normali, ma il loro ruolo è ancora un mistero. Il fatto che noi li abbiamo trovati in quantità significativamente maggiori nei pazienti con artrite infiammatoria, indipendentemente dal tipo specifico o dalla presenza di ACPA, suggerisce fortemente che possano avere un ruolo patogenetico, cioè che contribuiscano in qualche modo allo sviluppo o al mantenimento della malattia. Sono una causa o una conseguenza dell’infiammazione cronica? Bella domanda!
Sappiamo che i neutrofili sono abbondanti nelle articolazioni infiammate (sinovia) dei pazienti con IA, e in particolare nella pelle e nelle entesi (i punti di inserzione di tendini e legamenti sull’osso) dei pazienti con PsA. Il fatto di trovarli anche nei linfonodi, che sono le centrali operative dell’immunità, apre scenari completamente nuovi. Potrebbero trasportare antigeni? Potrebbero influenzare l’attivazione di altre cellule immunitarie come i linfociti T?
Limiti e Prospettive Future
Certo, il nostro studio ha dei limiti, come il numero non enorme di campioni analizzati, soprattutto per l’immunoistochimica. Ottenere biopsie linfonodali da pazienti e controlli sani non è semplice! Inoltre, studiare i neutrofili nei tessuti è tecnicamente difficile, sono cellule delicate e dalla vita breve. Forse è per questo che le tecniche basate su singole cellule potrebbero non averli “visti” così chiaramente in passato. Il nostro approccio di analizzare l’intero tessuto ci ha permesso di cogliere questa “firma neutrofila”.
Nonostante i limiti, credo che questi risultati siano davvero importanti. Per la prima volta, abbiamo identificato firme geniche distinte nei linfonodi di pazienti con IA ACPA-negativa e, soprattutto, abbiamo evidenziato questa inaspettata presenza di neutrofili nei linfonodi durante l’artrite infiammatoria, anche senza infezioni.
Ora la sfida è capire cosa ci fanno lì questi neutrofili. Da dove arrivano? Che caratteristiche specifiche hanno (sono diversi da quelli del sangue)? Come interagiscono con le altre cellule immunitarie nel linfonodo? Rispondere a queste domande sarà cruciale per comprendere meglio i meccanismi alla base dell’artrite infiammatoria e, magari, per trovare nuovi bersagli terapeutici. Il mistero dei neutrofili nei linfonodi è appena iniziato!
Fonte: Springer