Il Cervello in Ascolto: Come i Neuroni Vagali Decifrano i Messaggi Segreti dell’Infiammazione
Avete mai pensato a come il vostro corpo sa di essere “sotto attacco” durante un’infezione o dopo un infortunio? Certo, sentiamo dolore, febbre, stanchezza… ma come fa il nostro cervello a ricevere queste notizie dal fronte? Beh, sembra che ci sia una linea di comunicazione diretta e incredibilmente sofisticata tra il sistema immunitario e il sistema nervoso, e io ho avuto la fortuna di poter sbirciare un po’ dietro le quinte di questa affascinante conversazione.
Il nostro corpo, quando rileva un danno o un’infezione, scatena una risposta universale chiamata infiammazione. È un meccanismo di difesa essenziale, orchestrato da messaggeri chimici chiamati citochine. Queste molecole sono un po’ come i tweet del sistema immunitario: brevi messaggi che dicono “Ehi, qui c’è un problema!” oppure “Ok, possiamo iniziare a riparare”. Sappiamo da tempo che queste informazioni arrivano al cervello, ma come esattamente il sistema nervoso le “legge” e le interpreta è rimasto un mistero affascinante.
Spiare i Neuroni in Diretta
Per capirci qualcosa di più, ci siamo concentrati su un attore chiave: il nervo vago. Questo è come un’autostrada informativa che collega i nostri organi interni al cervello. Le “stazioni di servizio” lungo questa autostrada sono i gangli vagali, ammassi di corpi cellulari dei neuroni sensoriali. Abbiamo pensato: e se fossero proprio questi neuroni, nei gangli (in particolare nel ganglio nodoso), la prima stazione neurale a “sentire” le citochine?
Per verificarlo, abbiamo usato una tecnica pazzesca chiamata in vivo calcium imaging. In pratica, abbiamo modificato geneticamente dei topi in modo che i loro neuroni vagali (specificamente quelli glutammatergici, identificati dal marcatore Vglut2) producessero una proteina fluorescente (GCaMP6f) che si illumina quando il neurone è attivo. Usando un microscopio miniaturizzato (un Miniscope) posizionato direttamente sui gangli vagali di topi vivi e anestetizzati, abbiamo potuto letteralmente guardare i singoli neuroni accendersi in tempo reale mentre applicavamo diverse citochine direttamente sul nervo vago.
Un Linguaggio Neurale per le Citochine
E qui è arrivata la sorpresa! Abbiamo testato tre citochine importanti: l’interleuchina-1β (IL-1β) e il fattore di necrosi tumorale (TNF), entrambe tipicamente pro-infiammatorie, e l’interleuchina-10 (IL-10), generalmente anti-infiammatoria. Quello che abbiamo visto è stato sbalorditivo:
- Alcuni neuroni si attivavano selettivamente solo per una specifica citochina. Come se avessero un’antenna sintonizzata solo su quel segnale.
- Altri neuroni, invece, rispondevano a più di una citochina, ma – ed è questo il punto cruciale – lo facevano con schemi di attività distinti per ciascuna. Immaginate un neurone che “lampeggia” in un modo per IL-1β e in un modo diverso per TNF.
Questo ci dice che i neuroni del ganglio nodoso non si limitano a dire “sì/no” all’infiammazione, ma sono in grado di codificare l’identità specifica della citochina che incontrano. È come se avessero un vero e proprio linguaggio neurale per descrivere lo stato immunitario locale! Abbiamo anche visto che questa risposta è più legata al *tipo* di citochina che alla sua *concentrazione*: i neuroni sembrano più interessati a sapere *chi* sta parlando piuttosto che a *quanto* forte stia gridando.
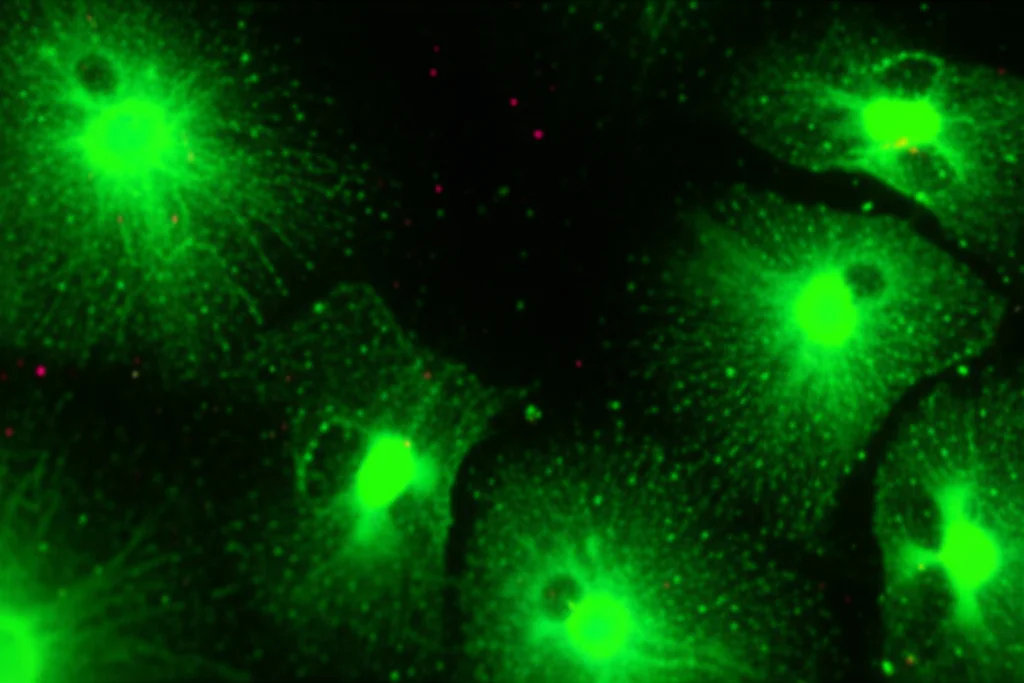
Per confermare che questi neuroni avessero l’equipaggiamento giusto, abbiamo usato l’immunoistochimica per cercare i recettori per queste citochine. Eccoli lì! Sulla superficie dei corpi cellulari nel ganglio nodoso abbiamo trovato recettori per IL-1β (IL-1R1) e per TNF (TNFR1). Curiosamente, molti neuroni li esprimevano entrambi, supportando l’idea che un singolo neurone possa “ascoltare” più messaggi immunitari contemporaneamente, ma abbiamo anche trovato popolazioni che esprimevano solo uno dei due, o nessuno, in linea con le nostre osservazioni funzionali.
Quando l’Infiammazione Alza il Volume (e Confonde i Segnali)
Ma cosa succede a questa raffinata comunicazione quando c’è un’infiammazione cronica in corso? Per scoprirlo, abbiamo indotto una colite (un’infiammazione dell’intestino) in un gruppo di topi usando DSS (destrano solfato di sodio) nell’acqua da bere, un modello che mima alcune caratteristiche della malattia infiammatoria intestinale umana (IBD).
Come previsto, i topi con colite hanno mostrato i segni tipici della malattia: perdita di peso, colon accorciato e infiammato, e livelli elevati di varie citochine sia nel sangue che nel tessuto del colon, specialmente al picco della malattia (intorno al giorno 7).
Siamo quindi tornati a spiare i loro neuroni vagali. I risultati sono stati illuminanti (letteralmente e metaforicamente!):
- Più rumore di fondo: Nei topi con colite, abbiamo osservato un numero significativamente maggiore di neuroni spontaneamente attivi nel ganglio nodoso, anche senza stimolazione diretta con citochine. Era come se l’infiammazione generale avesse reso i neuroni più “nervosi” o eccitabili.
- Segnali più deboli e confusi: Nonostante questa maggiore attività di base, quando abbiamo applicato le citochine specifiche (TNF e IL-10), l’ampiezza della risposta dei singoli neuroni era ridotta rispetto ai topi sani. Non solo, ma usando analisi multidimensionali, abbiamo visto che la “firma” neurale specifica per ogni citochina diventava meno distinguibile. Era più difficile separare i cluster di risposte per IL-1β, TNF e IL-10 nei topi con colite rispetto ai controlli. L’infiammazione sembrava degradare la precisione del segnale.
Dentro i Geni: Cosa Cambia con l’Infiammazione?
Per capire cosa stesse succedendo a livello molecolare dentro questi neuroni, abbiamo analizzato l’espressione genica (usando l’RNA sequencing) nei gangli vagali dei topi con colite al picco della malattia. I risultati hanno confermato e ampliato le nostre osservazioni funzionali:
- Su i geni per l’attività neurale: Abbiamo trovato un aumento dell’espressione di geni legati alla segnalazione neuronale, come canali ionici (es. Scn10a, un canale del sodio importante per l’eccitabilità), rilascio di neurotrasmettitori (Syt7) e regolazione del potenziale di membrana. Questo potrebbe spiegare l’aumento dell’attività spontanea che avevamo osservato.
- Giù i geni per la risposta alle citochine: Contemporaneamente, abbiamo visto una diminuzione dell’espressione di geni coinvolti nelle vie di segnalazione delle citochine (come recettori o molecole di segnalazione a valle, es. Tnfrsf12a, Il12a, geni legati alla via JAK-STAT). Questo potrebbe spiegare perché i neuroni rispondevano meno intensamente alle citochine specifiche durante la colite.
In pratica, sembra che durante l’infiammazione cronica, i neuroni vagali si “sintonizzino” diversamente: diventano più attivi in generale, ma meno sensibili o specifici nel rispondere ai segnali immunitari che dovrebbero rilevare. È un cambiamento affascinante che suggerisce una plasticità notevole in questa via di comunicazione neuroimmune.
Perché Tutto Questo è Importante?
Queste scoperte aprono una nuova finestra sulla comprensione di come il nostro corpo gestisce l’infiammazione e come questa comunicazione possa andare storta nelle malattie croniche. Non si tratta solo di un semplice relè che trasmette un segnale di allarme generico al cervello. I neuroni vagali sensoriali stanno attivamente elaborando e codificando informazioni immunitarie specifiche già alla periferia.
Questo ha implicazioni enormi:
- Comprensione dei sintomi: La sensazione di malessere generale (“sickness behavior”) che proviamo durante un’infezione potrebbe essere legata a come questi segnali specifici vengono interpretati dal cervello. L’alterazione di questi segnali nell’infiammazione cronica potrebbe contribuire a sintomi persistenti o a ipersensibilità viscerale, come si vede nell’IBD.
- Riflessi neuroimmuni: Il cervello usa queste informazioni per attivare risposte riflesse che possono modulare l’infiammazione stessa (come il famoso “riflesso infiammatorio”). Capire come i segnali vengono codificati è fondamentale per capire come funzionano questi riflessi.
- Nuove terapie: La stimolazione del nervo vago (VNS) è già utilizzata o studiata per trattare diverse condizioni, incluse malattie infiammatorie come l’artrite reumatoide e l’IBD. I nostri risultati suggeriscono che la VNS potrebbe funzionare non solo modulando l’output motorio del nervo vago, ma forse anche influenzando o ripristinando la corretta codifica dei segnali sensoriali immunitari. Comprendere questo codice neurale potrebbe portare a terapie di neuromodulazione più mirate ed efficaci.
Un Nuovo Capitolo nella Comunicazione Corpo-Cervello
In conclusione, il nostro viaggio all’interno dei gangli vagali ci ha mostrato che la comunicazione tra sistema immunitario e nervoso è molto più dinamica e complessa di quanto pensassimo. I neuroni sensoriali vagali non sono semplici messaggeri passivi, ma veri e propri decodificatori in tempo reale dei segnali infiammatori. Creano rappresentazioni neurali distinte per diverse citochine, un codice che viene però alterato durante l’infiammazione cronica.
Questo apre scenari entusiasmanti per la ricerca futura. Come viene ulteriormente elaborata questa informazione nel cervello? Come contribuiscono altre vie sensoriali? E, soprattutto, possiamo imparare a “parlare” questo linguaggio neuroimmune per sviluppare nuove strategie contro le malattie infiammatorie?
Il cervello è davvero in ascolto, e stiamo solo iniziando a capire cosa sente.
Fonte: Springer