Melanoma: Ho Visto Nanoparticelle Intelligenti Risvegliare le Difese Immunitarie!
Amici della scienza, oggi voglio raccontarvi di una scoperta che mi ha letteralmente elettrizzato, una di quelle che ti fa pensare: “Wow, la ricerca sta facendo passi da gigante!”. Parliamo di melanoma, un nemico davvero ostico, un tipo di cancro della pelle aggressivo e difficile da trattare. Negli ultimi anni, l’immunoterapia, e in particolare il blocco dei checkpoint immunitari (ICB), ha rappresentato una vera rivoluzione, regalando speranza e anni di vita in più a molti pazienti. Ma, come spesso accade nella scienza, c’è un “ma”.
La Sfida: Quando il Sistema Immunitario Ha Bisogno di una Spinta
L’immunoterapia con inibitori di PD-1, per esempio, funziona “sbloccando” i nostri linfociti T, i soldati del nostro sistema immunitario, permettendo loro di attaccare le cellule tumorali. Il problema è che questa strategia non funziona per tutti. Perché? Principalmente per due motivi: la scarsa immunogenicità del tumore e l’insufficiente infiltrazione di linfociti T. In parole povere, a volte il tumore è così “bravo” a nascondersi che il sistema immunitario non lo riconosce come una minaccia (scarsa immunogenicità), oppure, anche se lo riconosce, i linfociti T non riescono a raggiungere il campo di battaglia in numero sufficiente (insufficiente infiltrazione). Circa il 70% dei tumori mostra questa scarsa infiltrazione, limitando di molto l’efficacia dell’ICB. È chiaro, quindi, che serviva una strategia per affrontare entrambi questi ostacoli contemporaneamente.
La Nostra Idea Geniale: Una Nanopiattaforma “Due in Uno”
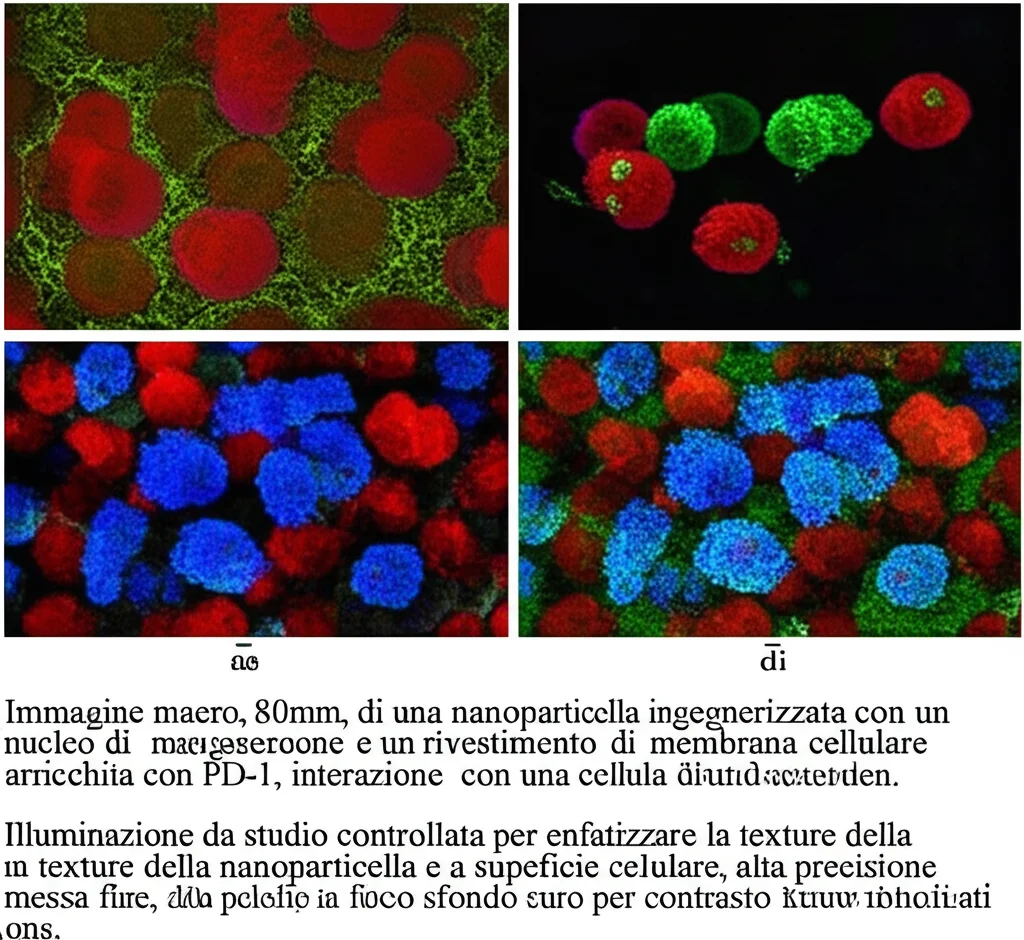
Ed è qui che entra in gioco la nostra ricerca e la protagonista di questa storia: una nanopiattaforma biomimetica che abbiamo chiamato BPC9@MnCO3. Lo so, il nome sembra uno scioglilingua, ma vi assicuro che è un concentrato di ingegneria e biologia! Immaginatevela come un minuscolo veicolo super-intelligente, progettato per colpire il melanoma su più fronti.
Come l’abbiamo costruita? Abbiamo fatto qualcosa di davvero furbo:
- Abbiamo preso delle membrane di cellule di melanoma (B16-F10, nel nostro modello sperimentale) e le abbiamo “ingegnerizzate” per far loro esprimere grandi quantità di proteina PD-1 sulla loro superficie. Perché PD-1? Perché PD-1 è il recettore sui linfociti T a cui si lega PD-L1, una proteina espressa dalle cellule tumorali per “spegnere” l’attacco immunitario. La nostra idea è che queste membrane ricche di PD-1, una volta arrivate al tumore, “ingannino” le cellule tumorali, legandosi al loro PD-L1 e impedendo così che questo possa disattivare i veri linfociti T. Una sorta di “blocco preventivo”!
- Abbiamo “rivestito” con queste membrane modificate delle nanoparticelle di carbonato di manganese (MnCO3). Questo rivestimento biomimetico ha un duplice vantaggio: aiuta le nanoparticelle a mimetizzarsi e a raggiungere specificamente il tessuto tumorale (homing tumorale).
- All’interno di questo sistema, abbiamo caricato una chemochina chiamata CXCL9. Le chemochine sono molecole che attirano specifiche cellule immunitarie, e CXCL9 è nota per richiamare i linfociti T nel sito del tumore.
Quindi, ricapitolando: abbiamo una nanoparticella “camuffata” con la membrana di cellule tumorali, potenziata con PD-1 per bloccare le difese del tumore, e caricata con CXCL9 per chiamare a raccolta i rinforzi (i linfociti T). Ma non è finita qui!
Il Meccanismo d’Azione: Un Attacco Coordinato
Una volta che la nostra BPC9@MnCO3 raggiunge il tumore, inizia la magia. Il microambiente tumorale è tipicamente acido. Questa acidità fa sì che il nucleo di MnCO3 si decomponga, rilasciando ioni manganese (Mn2+). E qui succedono due cose fondamentali:
- Gli ioni Mn2+ sono in grado di scatenare un tipo di morte cellulare chiamata morte cellulare immunogenica (ICD). Durante l’ICD, le cellule tumorali morenti rilasciano dei segnali di “pericolo” (chiamati DAMPs, come la calreticulina e HMGB1) che allertano il sistema immunitario, rendendo il tumore molto più “visibile” e stimolando la maturazione delle cellule dendritiche (le “sentinelle” che presentano gli antigeni tumorali ai linfociti T). Inoltre, gli Mn2+ possono attivare la via cGAS-STING, un altro potente meccanismo di attivazione immunitaria.
- La degradazione del MnCO3 provoca anche la rottura della membrana che lo avvolge, rilasciando localmente la chemochina CXCL9. Questo crea un forte richiamo per i linfociti T, che iniziano a infiltrarsi massicciamente nel tumore.
In pratica, la nostra nanopiattaforma non solo smaschera il tumore e lo rende più vulnerabile (ICD), ma “disarma” anche le sue difese (blocco PD-1/PD-L1) e chiama i rinforzi (CXCL9 e infiltrazione di linfociti T). Un vero e proprio attacco combinato!
I Risultati: Promesse Mantenute (almeno in Laboratorio!)
Ovviamente, non ci siamo fermati alla teoria. Abbiamo testato la BPC9@MnCO3 sia in vitro (su cellule in coltura) sia in vivo (su modelli animali di melanoma). E i risultati, ve lo dico col cuore, sono stati entusiasmanti!
Negli esperimenti in vitro, abbiamo visto che le nostre nanoparticelle venivano internalizzate efficacemente dalle cellule tumorali, inducevano la produzione di specie reattive dell’ossigeno (ROS) – un altro meccanismo che contribuisce alla morte cellulare – e, come sperato, scatenavano l’ICD con rilascio di DAMPs. Abbiamo anche confermato che il PD-1 sulle membrane ingegnerizzate bloccava efficacemente il PD-L1 sulle cellule tumorali e che il CXCL9 rilasciato attirava i linfociti T.
Ma è negli studi in vivo che abbiamo avuto le conferme più importanti. Nei topi con melanoma, il trattamento con BPC9@MnCO3 ha portato a:
- Una significativa inibizione della crescita tumorale. I tumori trattati erano molto più piccoli rispetto a quelli dei gruppi di controllo.
- Una riduzione del numero di metastasi polmonari. Questo è un risultato cruciale, perché le metastasi sono la principale causa di mortalità nel melanoma.
- Un miglioramento del microambiente immunitario del tumore, con un aumento dell’infiltrazione di linfociti T (sia CD8+ che CD4+) e una maggiore attivazione delle cellule dendritiche.
- Un aumento nel siero dei topi trattati di citochine infiammatorie “buone” come IFN-γ e TNF-α, segnali di una robusta risposta immunitaria.
Abbiamo anche verificato la biocompatibilità del nostro sistema, e i risultati preliminari sulla tossicità sono stati incoraggianti, senza evidenti effetti collaterali sistemici.
Cosa Significa Tutto Questo per il Futuro?
Beh, per me significa tantissimo! Questa ricerca dimostra che è possibile sviluppare strategie innovative per superare alcuni dei limiti più frustranti dell’immunoterapia attuale. L’idea di combinare in un’unica nanopiattaforma un meccanismo per aumentare l’immunogenicità del tumore (ICD indotta da Mn2+), un sistema per bloccare i checkpoint immunitari (PD-1 ingegnerizzato) e un modo per richiamare le cellule T (CXCL9) è, a mio parere, vincente.
Certo, la strada verso l’applicazione clinica è ancora lunga e richiederà ulteriori studi, soprattutto per valutare la sicurezza a lungo termine e l’efficacia in modelli più complessi che mimino la malattia umana. Ad esempio, sarà importante studiare meglio come questa strategia influenzi le varie popolazioni di cellule immunitarie nei linfonodi drenanti, per capire appieno la sua azione a livello sistemico. Tuttavia, i risultati ottenuti finora sono una solida base di partenza e aprono nuove, eccitanti prospettive per il trattamento del melanoma e, potenzialmente, di altri tipi di tumore “freddi”, cioè quelli che rispondono poco all’immunoterapia tradizionale.
È un esempio lampante di come l’unione tra nanotecnologia, ingegneria genetica e immunologia possa portare a soluzioni terapeutiche sempre più mirate e potenti. E io non vedo l’ora di vedere dove ci porteranno i prossimi passi di questa affascinante avventura scientifica!
Fonte: Springer