Nanoparticelle di Ossido di Grafene: Un Raggio di Luce Contro il Cancro al Fegato?
Ciao a tutti! Oggi voglio parlarvi di qualcosa di veramente affascinante che sta emergendo dalla frontiera della ricerca medica: l’uso di nanoparticelle, in particolare quelle derivate dall’ossido di grafene, per combattere uno dei tumori più aggressivi, il carcinoma epatocellulare (HCC), ovvero il cancro al fegato. So che “nanoparticelle di ossido di grafene” suona complicato, ma datemi un attimo e vi spiego perché questa roba è così promettente.
Il Problema: Un Nemico Silenzioso e Aggressivo
Partiamo dal nemico: il carcinoma epatocellulare. È uno dei tumori più diffusi e letali al mondo. Pensate che nel 2022 è stata la terza causa di morte per cancro, portandosi via quasi 760.000 persone. Il problema è che spesso viene diagnosticato tardi, quando è già avanzato, perché all’inizio non dà sintomi chiari. E quando arriva la diagnosi, le terapie tradizionali come la chemioterapia spesso non bastano, a causa della resistenza del tumore e della sua eterogeneità. C’è un bisogno disperato di nuove strategie, più mirate ed efficaci.
Una Nuova Speranza: La Terapia Fototermica (PTT)
Qui entra in gioco la terapia fototermica (PTT). Immaginate di poter “scaldare” le cellule tumorali fino a ucciderle, lasciando intatti i tessuti sani circostanti. Sembra fantascienza, vero? Eppure, è proprio questo il principio della PTT. Si usano degli “agenti fototermici” (PTA), materiali speciali che, una volta nel tumore, assorbono la luce, specialmente quella nel vicino infrarosso (NIR) – che penetra bene nei tessuti – e la convertono in calore. Questo calore localizzato fa salire la temperatura nel microambiente tumorale, inducendo la morte delle cellule cancerose per necrosi o apoptosi (una sorta di “suicidio cellulare programmato”).
La PTT classica usa laser potenti che portano la temperatura sopra i 50°C (termoablazione). Funziona, ma il calore può diffondersi e danneggiare anche cellule sane, causando infiammazione e, paradossalmente, aumentando il rischio di metastasi. Per ovviare a questo, è stata sviluppata la terapia fototermica a temperatura mite (mPTT), che mantiene la temperatura tra i 42 e i 45°C. È più sicura, riduce i danni collaterali e può persino rendere le cellule tumorali più sensibili ad altre terapie come chemio e radio, spingendole verso l’apoptosi.
I Protagonisti: Nanoparticelle di Ossido di Grafene (nGO e nGO-PEG)
Ok, ma come facciamo a portare questi agenti fototermici proprio lì dove servono, specialmente nei tumori profondi? Qui entrano in scena i nanomateriali, e in particolare quelli a base di grafene (GBNM), come l’ossido di grafene (GO). Il GO è fantastico per la PTT: assorbe tantissimo la luce NIR, la converte in calore in modo super efficiente, è relativamente poco tossico e la sua superficie si può modificare facilmente.
Nel nostro studio, abbiamo preso l’ossido di grafene e lo abbiamo reso “nano” (nGO). Ma non ci siamo fermati qui. Abbiamo anche creato una versione “PEGilata” (nGO-PEG). Cosa significa? Abbiamo attaccato alla superficie delle nanoparticelle delle molecole di polietilenglicole (PEG). Questo trucchetto rende le nanoparticelle più “amichevoli” per il corpo (biocompatibili), le fa circolare più a lungo nel sangue senza essere eliminate subito e, cosa importantissima, migliora ulteriormente la loro capacità di assorbire la luce NIR. Abbiamo usato un metodo di sintesi innovativo, “one-step”, che non produce scarti tossici.
Messe alla Prova: Cosa Succede alle Cellule Tumorali?
Abbiamo quindi preso queste due versioni di nanoparticelle, nGO e nGO-PEG, e le abbiamo testate su cellule di carcinoma epatocellulare (la linea cellulare HepG2) in laboratorio. Le abbiamo esposte alle nanoparticelle e poi le abbiamo illuminate con un laser NIR a 808 nm per 5 minuti. Volevamo vedere cosa succedeva a livello cellulare e molecolare.
Ecco cosa abbiamo scoperto:
- Effetto Termico: Entrambe le nanoparticelle si scaldano sotto il laser, ma nGO-PEG lo fa molto di più! Ha mostrato un aumento di temperatura di 4.6°C, quasi tre volte quello di nGO (1.4°C). Questo conferma che la PEGiliazione migliora l’efficienza fototermica. Questo calore “mite” è proprio quello che cercavamo per la mPTT.
- Tossicità e Vitalità Cellulare: Senza laser, nGO si è rivelato più tossico per le cellule HepG2 rispetto a nGO-PEG, riducendo la loro vitalità e danneggiandone la morfologia. Questo conferma che la PEGiliazione rende le nanoparticelle più biocompatibili. Quando abbiamo aggiunto l’irradiazione NIR, la tossicità è aumentata per entrambe, ma in modi diversi.
- Morfologia e Migrazione: Le nanoparticelle, specialmente con il laser, hanno cambiato l’aspetto delle cellule tumorali, rendendole più allungate, arrotondate e mostrando segni di danno come la vacuolizzazione (formazione di “bolle” nel citoplasma). È interessante notare che nGO-PEG è stato più efficace nel bloccare la capacità delle cellule di “muoversi” e chiudere una “ferita” simulata in laboratorio (wound healing assay), un indicatore chiave del potenziale metastatico.
- Dentro la Cellula: Citoscheletro e Mitocondri: Abbiamo dato un’occhiata più da vicino. Entrambe le nanoparticelle, potenziate dal NIR, hanno scombussolato l’organizzazione del citoscheletro di actina, la struttura interna che dà forma alla cellula e le permette di muoversi. I filamenti ordinati sono spariti, sostituiti da accumuli disorganizzati. Anche i mitocondri, le centrali energetiche della cellula, sono stati colpiti. Abbiamo osservato cambiamenti nella loro forma e distribuzione, suggerendo un aumento della fissione (divisione) mitocondriale e, in alcuni casi (nGO + NIR), una diminuzione dell’intensità della fluorescenza, segno di danno e depolarizzazione. Curiosamente, nGO-PEG + NIR sembrava invece aumentare l’attività mitocondriale. Anche la dimensione dei nuclei cellulari è cambiata in modo diverso a seconda del trattamento.
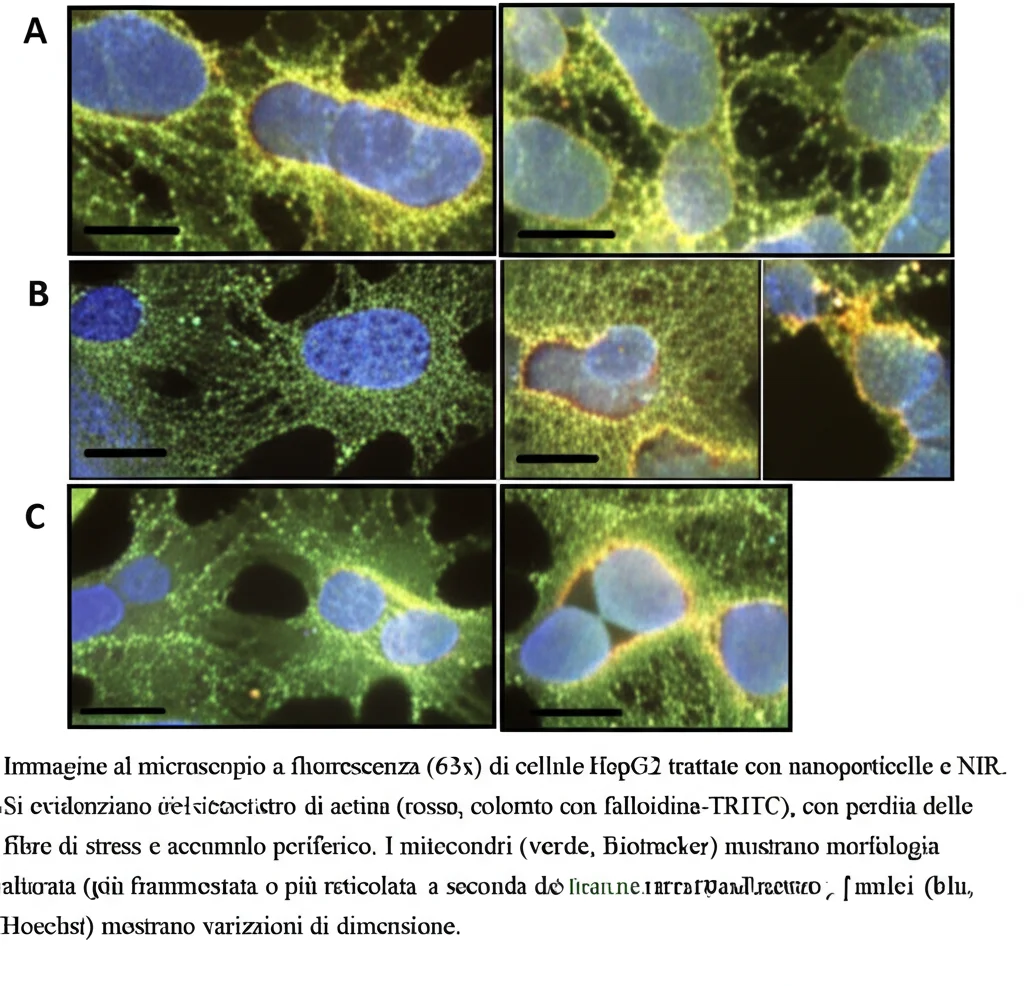
- Stress Ossidativo (ROS): Le nanoparticelle, soprattutto con il NIR, hanno causato un aumento significativo delle specie reattive dell’ossigeno (ROS) all’interno delle cellule. I ROS sono molecole che, in eccesso, danneggiano lipidi, proteine e DNA, contribuendo alla morte cellulare. Questo stress ossidativo è probabilmente uno dei meccanismi chiave dietro l’effetto tossico osservato, specialmente per il danno ai mitocondri.
- Integrità della Membrana (LDH): Ci aspettavamo che le nanoparticelle danneggiassero la membrana cellulare. Sorprendentemente, misurando il rilascio dell’enzima LDH (un indicatore di danno alla membrana), abbiamo visto una riduzione del rilascio nelle cellule trattate rispetto ai controlli. Una possibile spiegazione è che il calore mite generato non sia sufficiente a rompere la membrana, ma possa alterarne la fluidità o la riorganizzazione, ostacolando il rilascio di LDH. È un risultato inaspettato che merita ulteriori indagini.
La Storia Molecolare: Apoptosi vs Autofagia
Ma la parte più intrigante è forse quella che riguarda i geni. Abbiamo analizzato l’espressione di alcuni geni chiave coinvolti nella morte cellulare programmata (apoptosi e autofagia), nel controllo del ciclo cellulare e nella metastasi.
Qui le strade di nGO e nGO-PEG si dividono nettamente, soprattutto quando combinate con il laser NIR:
- nGO-PEG + NIR: La Via dell’Apoptosi. Questo trattamento ha causato un aumento significativo dell’espressione dei geni pro-apoptotici BAX e CASP8. L’aumento di BAX suggerisce un danno diretto ai mitocondri (che porta al rilascio di fattori che innescano l’apoptosi), mentre l’aumento di CASP8 indica l’attivazione sia della via intrinseca (legata ai mitocondri) sia di quella estrinseca (mediata da recettori di morte). Questo conferma che nGO-PEG + NIR spinge le cellule tumorali verso il “suicidio programmato”.
- nGO + NIR: La Via dell’Autofagia. Con nGO, invece, non abbiamo visto un aumento significativo di CASP8. In compenso, abbiamo osservato un netto aumento dell’espressione di BECN1, un gene fondamentale per l’autofagia. L’autofagia è un processo in cui la cellula “mangia” parti di sé stessa danneggiate per riciclarle o per sopravvivere a condizioni di stress. In alcuni contesti tumorali, però, un’eccessiva autofagia può portare alla morte cellulare. Sembra quindi che nGO, specialmente con il NIR, induca uno stress tale da attivare potentemente questo meccanismo.
- Blocco del Ciclo Cellulare e Riduzione Metastasi: Entrambi i trattamenti (nGO-PEG + NIR in modo più marcato) hanno portato a un forte aumento di CDKN1A (che codifica per la proteina p21), un freno importante del ciclo cellulare. Questo suggerisce che le nanoparticelle bloccano la proliferazione delle cellule tumorali. Inoltre, abbiamo visto una riduzione dell’espressione di HMMR, un gene associato alla capacità delle cellule di migrare e formare metastasi, in linea con i risultati del wound healing assay.

Conclusioni: Due Strade per lo Stesso Obiettivo
Cosa ci dice tutto questo? Che abbiamo tra le mani due strumenti potenzialmente potenti, ma con meccanismi d’azione distinti.
L’nGO si comporta come un agente citotossico più “brutale”, inducendo stress e attivando l’autofagia, forse come tentativo disperato della cellula di salvarsi, che però può portare alla morte.
L’nGO-PEG, invece, è più “subdolo” e biocompatibile. Grazie alla sua maggiore efficienza fototermica e alla sua interazione più “soft” con la cellula, quando attivato dal NIR, spinge elegantemente le cellule tumorali verso l’apoptosi, sfruttando il danno mitocondriale indotto dal calore mite e dai ROS.
Questa scoperta è entusiasmante perché apre la strada a strategie terapeutiche personalizzate. A seconda delle caratteristiche specifiche del tumore di un paziente, si potrebbe scegliere la nanoparticella (nGO o nGO-PEG) e il meccanismo d’azione (autofagia o apoptosi) più adatti per massimizzare l’efficacia della terapia fototermica, minimizzando gli effetti collaterali.
Certo, siamo ancora a livello di studi *in vitro*, su cellule in laboratorio. La strada verso l’applicazione clinica è ancora lunga e richiede ulteriori ricerche, specialmente *in vivo*, per confermare questi risultati e valutare la sicurezza a lungo termine. Ma i risultati sono incredibilmente promettenti e ci danno uno sguardo affascinante su come la nanotecnologia potrebbe rivoluzionare la lotta contro il cancro al fegato e, potenzialmente, altre forme tumorali. Stiamo davvero usando la luce per accendere la speranza!
Fonte: Springer