Nanoparticelle Intelligenti: La Nuova Arma Contro il Cancro al Seno?
Ciao a tutti! Oggi voglio parlarvi di qualcosa di veramente affascinante che sta succedendo nel mondo della ricerca medica, in particolare nella lotta contro il cancro al seno. Sappiamo tutti quanto sia cruciale una diagnosi precoce e accurata per questa malattia, che purtroppo è ancora una delle principali cause di preoccupazione per la salute delle donne in tutto il mondo. Nonostante i passi da gigante fatti nella diagnosi e nel trattamento, trovare modi sempre più efficaci e meno invasivi per “vedere” il tumore nelle sue fasi iniziali è una sfida continua.
La Sfida della Diagnosi Precoce
La diagnosi precoce è la chiave, vero? Permette di pianificare trattamenti tempestivi ed efficaci, migliorando notevolmente le possibilità di successo. Ma come possiamo migliorare ancora? Le tecniche di imaging diagnostico, come la risonanza magnetica (RM), sono strumenti potentissimi. La RM ci regala immagini dettagliate dei tessuti molli, con una risoluzione spaziale incredibile e informazioni tridimensionali, il tutto senza usare radiazioni ionizzanti. Fantastico, no?
Però, c’è un “ma”. La sensibilità intrinseca della RM a volte non basta per scovare tumori molto piccoli o le temute micrometastasi. Per questo, spesso si ricorre agli agenti di contrasto, sostanze che migliorano la visibilità delle strutture che vogliamo studiare.
Agenti di Contrasto: T1 vs T2 e i Loro Limiti
Gli agenti di contrasto per la RM si dividono principalmente in due categorie: T1-pesati (T1w) e T2-pesati (T2w). Quelli T1 “accendono” l’immagine, rendendola più brillante nelle zone dove si accumulano, mentre quelli T2 la “spengono”, creando aree scure.
I mezzi di contrasto T2, spesso basati su nanoparticelle di ossido di ferro superparamagnetico (SPION), sono molto sensibili, ma hanno un difetto: creano un effetto chiamato “blooming”. In pratica, l’area scura che generano sull’immagine è più grande dell’oggetto reale, rendendo difficile localizzare con precisione l’agente di contrasto. Immaginate di cercare una piccola luce spenta in una stanza buia… non è facile capire esattamente dov’è! Questo, unito ad altre aree scure che possono esserci naturalmente (depositi di metallo, calcificazioni, sanguinamenti), complica le cose.
Per questo, gli agenti di contrasto T1 sono spesso preferiti in clinica. Rendono l’immagine più chiara, distinguono meglio i tessuti e non hanno l’effetto blooming. I più usati sono a base di Gadolinio (GBCAs). Peccato che anche loro abbiano dei lati oscuri: possono causare una grave condizione chiamata fibrosi sistemica nefrogenica in alcuni pazienti e tendono ad accumularsi nel cervello. La stessa FDA ha lanciato degli allarmi. C’è bisogno di alternative più sicure ed efficaci.
Nanoparticelle USPIO: Piccole, Sicure e… Brillanti!
Ed è qui che entrano in gioco le nanoparticelle ultrasmall di ossido di ferro superparamagnetico (USPIO NPs). “Ultrasmall” significa che sono piccolissime, sotto i 5 nanometri! Questa dimensione ridotta cambia le carte in tavola. A differenza delle loro cugine più grandi (le SPION), le USPIO tendono a potenziare il segnale T1 (quello che “accende” l’immagine) piuttosto che quello T2. Hanno un’elevata forza magnetica, sono sicure e biocompatibili. Il rapporto ideale per un agente T1 è avere un alto valore di “rilassività” r1 (la capacità di accorciare il tempo di rilassamento T1) e un basso rapporto r2/r1. Le USPIO sembrano avere le caratteristiche giuste!
Ma c’è ancora un problema: anche queste nanoparticelle, da sole, non sono specifiche. Vanno un po’ ovunque nel corpo. Come possiamo indirizzarle precisamente verso le cellule tumorali?
Aggiungiamo un “GPS”: il Peptide FROP-1
La soluzione è il targeting molecolare. Si tratta di “decorare” le nostre nanoparticelle con una molecola che agisca come un GPS, riconoscendo e legandosi specificamente alle cellule tumorali. I peptidi (piccoli frammenti di proteine) sono candidati ideali: sono piccoli, specifici, poco tossici e stabili.
Nel 2007, un team di ricercatori ha identificato un peptide chiamato FROP-1. Studi successivi hanno mostrato che questo peptide ha una particolare affinità per alcune linee cellulari di cancro, tra cui la linea MCF-7, un tipo comune di cancro al seno. Hanno provato a marcarlo con isotopi radioattivi per l’imaging nucleare, con buoni risultati. Ma nessuno aveva ancora pensato di usarlo per migliorare il contrasto in RM.
Ecco l’idea brillante al centro dello studio che vi racconto oggi: coniugare, cioè legare chimicamente, il peptide FROP-1 alle nanoparticelle USPIO. L’obiettivo? Creare un agente di contrasto Fe3O4@FROP-1 che sia:
- Basato su USPIO (quindi potenzialmente un buon agente T1 e sicuro)
- Targettizzato grazie al FROP-1 (quindi specifico per le cellule tumorali che esprimono il suo recettore)
Questo approccio promette maggiore specificità, miglior contrasto e più sicurezza rispetto ai GBCAs e agli USPIO non mirati.
Come le Abbiamo Create e Testate?
I ricercatori hanno sintetizzato le nanoparticelle USPIO di Fe3O4 (magnetite) con un metodo chiamato co-precipitazione, stabilizzandole con citrato di sodio. Poi, hanno legato il peptide FROP-1 alla superficie di queste nanoparticelle usando un agente chimico (EDC).
Hanno quindi caratterizzato a fondo queste nuove nanoparticelle “intelligenti” (Fe3O4@FROP-1) e le loro controparti “nude” (Fe3O4):
- Dimensioni e Forma: Usando tecniche come DLS e TEM, hanno confermato che le nanoparticelle erano davvero “ultrasmall” (circa 3.8 nm di diametro) e di forma quasi sferica.
- Stabilità: Le misure del potenziale Zeta hanno indicato che le nanoparticelle erano stabili in soluzione.
- Conferma del Legame: La spettroscopia FT-IR ha confermato che il peptide FROP-1 era stato effettivamente legato alla superficie delle nanoparticelle.
- Proprietà Magnetiche: Analisi XRD e VSM hanno confermato la struttura cristallina della magnetite e le buone proprietà superparamagnetiche (Ms di 29 emu/g), adatte per applicazioni biomediche.

Funzionano Davvero? I Test In Vitro
Ok, le nanoparticelle sono state create. Ma funzionano come sperato? Per scoprirlo, sono stati fatti diversi test in vitro, cioè su cellule coltivate in laboratorio.
1. Biocompatibilità: Hanno usato il test MTT su diverse linee cellulari di cancro al seno (MCF-7, SKBR-3, MDA-MB-231) e su una linea cellulare normale (MCF-10). Risultato? Sia le Fe3O4 che le Fe3O4@FROP-1 hanno mostrato bassa tossicità, anche a concentrazioni relativamente alte. A concentrazioni realistiche per l’imaging (fino a 0.5 mM), la vitalità cellulare era altissima (oltre il 90-99%). Ottima notizia per la sicurezza!
2. Performance in Risonanza Magnetica: Hanno misurato le rilassività r1 e r2 delle nanoparticelle in acqua a diverse concentrazioni, usando uno scanner RM da 3 Tesla (come quelli usati in clinica). Hanno calcolato un valore di r1 di 2.608 mM⁻¹s⁻¹ e un rapporto r2/r1 di 1.18. Questo valore è molto basso (ben sotto il limite di 5 considerato per gli agenti T1), confermando che queste USPIO funzionano prevalentemente come agenti di contrasto T1. Hanno anche confrontato le performance con Dotarem (un comune agente a base di Gadolinio), mostrando risultati promettenti. All’aumentare della concentrazione di Fe, il segnale T1 (la luminosità) aumentava.
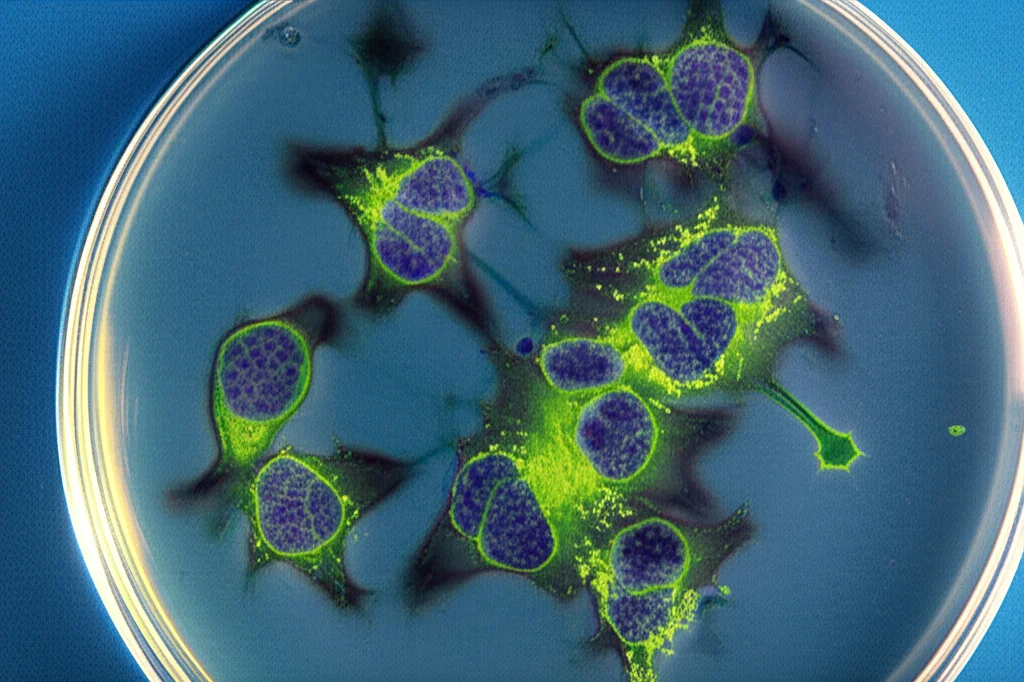
3. Capacità di Targeting (Cellular Uptake): Qui arriva il bello! Hanno incubato le cellule MCF-7 (quelle che dovrebbero legare FROP-1) con le nanoparticelle Fe3O4 e Fe3O4@FROP-1. Usando la tecnica ICP-MS per misurare il ferro all’interno delle cellule, hanno scoperto che le cellule trattate con Fe3O4@FROP-1 avevano assorbito circa 1.6 volte più ferro rispetto a quelle trattate con le nanoparticelle non targettizzate (Fe3O4). Questo dimostra che il peptide FROP-1 fa il suo lavoro, aumentando l’internalizzazione delle nanoparticelle nelle cellule bersaglio! Hanno anche fatto un esperimento di “blocco”: pre-trattando le cellule con FROP-1 libero, l’assorbimento delle Fe3O4@FROP-1 diminuiva, confermando che il legame avviene attraverso recettori specifici.
4. Imaging Cellulare: Infine, hanno preparato campioni di cellule (MCF-7, SKBR-3, MDA-MB-231, MCF-10) trattate con diverse concentrazioni di Fe3O4 e Fe3O4@FROP-1 e le hanno “fotografate” con la RM. Le immagini T1w hanno mostrato chiaramente che l’intensità del segnale (la luminosità) aumentava con la concentrazione di ferro per entrambe le nanoparticelle. Ma, cosa importante, nelle cellule MCF-7, l’incremento di segnale (misurato come SNR – Signal-to-Noise Ratio) era significativamente maggiore con le nanoparticelle targettizzate Fe3O4@FROP-1 rispetto a quelle non targettizzate. Questo conferma che il targeting porta a un accumulo maggiore dell’agente di contrasto e quindi a un’immagine RM più brillante e potenzialmente più diagnostica, proprio dove serve.
Cosa Significa Tutto Questo?
Questo studio in vitro è davvero promettente! Dimostra che è possibile creare nanoparticelle USPIO coniugate con il peptide FROP-1 che agiscono come un agente di contrasto T1 mirato ed efficace per le cellule di cancro al seno che esprimono il recettore per FROP-1.
I vantaggi potenziali sono enormi:
- Maggiore Specificità: Colpiscono il bersaglio, accumulandosi preferenzialmente nelle cellule tumorali.
- Miglior Contrasto T1: Forniscono immagini più brillanti e chiare, senza l’effetto blooming dei T2.
- Maggiore Sicurezza: Sono a base di ferro (biocompatibile) e non di Gadolinio, evitando i rischi associati.
- Diagnosi Precoce: Potrebbero permettere di individuare tumori più piccoli e micrometastasi.
Prossimi Passi e Visione Futura
Certo, siamo ancora alla fase in vitro. Il prossimo passo fondamentale sarà testare queste nanoparticelle in vivo, su modelli animali. Bisognerà studiare come si distribuiscono nel corpo (farmacocinetica e biodistribuzione), la loro efficacia nell’imaging di tumori reali e confermare la loro sicurezza a lungo termine.
Ma le potenzialità non finiscono qui. Queste piattaforme nanoparticellari sono versatili. Si potrebbero aggiungere altri ligandi per un targeting ancora più preciso, o addirittura caricare farmaci terapeutici, trasformandole in agenti “teranostici” (che combinano diagnosi e terapia).
Insomma, la strada è ancora lunga, ma la direzione è entusiasmante. Le nanoparticelle Fe3O4@FROP-1 rappresentano un passo avanti significativo verso una diagnosi per immagini del cancro al seno più precisa, sicura e personalizzata. Continueremo a seguire questi sviluppi con grande interesse!
Fonte: Springer







