Nanoparticelle Intelligenti: Un’Arma a Tripla Azione Contro il Cancro Sfruttando l’Ipossia Tumorale
Ciao a tutti! Oggi voglio parlarvi di qualcosa di veramente affascinante che sta emergendo nel campo della lotta contro il cancro: la nanomedicina. Immaginate di poter creare delle minuscole “navicelle” intelligenti, capaci non solo di trasportare farmaci direttamente al cuore del tumore, ma anche di rilasciarli solo quando serve e, addirittura, di combinare diverse strategie terapeutiche per un attacco sinergico. Sembra fantascienza? Beh, non proprio! È esattamente quello su cui stiamo lavorando, e i risultati sono incredibilmente promettenti.
La Sfida: Colpire il Tumore al Suo Punto Debole
Uno dei grossi problemi nel trattare i tumori solidi è che spesso, al loro interno, si crea un ambiente particolare, povero di ossigeno. Questa condizione, chiamata ipossia, è un po’ un’arma a doppio taglio: da un lato rende le cellule tumorali più resistenti ad alcune terapie come la radioterapia o certi tipi di chemio, ma dall’altro… ci offre un bersaglio! Se potessimo creare un sistema che si attiva proprio in queste zone ipossiche, potremmo colpire il tumore in modo molto più selettivo, risparmiando i tessuti sani.
La Nostra Idea: Un Nanoprofarmaco “Su Misura”
Ed è qui che entra in gioco la nostra creazione: un nanoprofarmaco sopramolecolare con nucleo reticolato, sensibile all’ipossia. Lo so, il nome è un po’ complesso (lo chiamiamo in breve CSN-IR806/CB), ma l’idea di base è geniale nella sua strategia. Abbiamo costruito una nanoparticella partendo da un “coniugato farmaco-farmaco dendritico”. Cosa significa?
In pratica, abbiamo preso una molecola fotosensibile (IR806), capace cioè di attivarsi con la luce e generare calore (terapia fototermica, PTT) e specie reattive dell’ossigeno (terapia fotodinamica, PDT), e l’abbiamo “decorata” con tante molecole di un farmaco chemioterapico (il Clorambucile, CB). La cosa furba è che abbiamo legato il CB all’IR806 usando un “gancio” speciale (un legame azobenzenico, Azo) che si spezza proprio quando c’è poco ossigeno, cioè in condizioni di ipossia.
Ma non basta. Per rendere stabile questa struttura e farla viaggiare sicura nel corpo, l’abbiamo fatta auto-assemblare insieme a un polimero speciale (PEG-PGlu-CD) che contiene delle “tasche” molecolari (le β-ciclodestrine). Queste tasche “ospitano” parti della nostra molecola farmaco-farmaco, creando una struttura sopramolecolare con un nucleo “reticolato”, super stabile grazie a un mix di interazioni (π-π stacking, ospite-ospitante, legami idrogeno, interazioni idrofobiche). Il risultato è una nanoparticella stabile nel sangue, ma pronta a “smontarsi” e rilasciare il suo carico una volta arrivata nel microambiente tumorale ipossico.
Come Funziona l’Attacco a Tre Punte?
Immaginate la scena: le nostre nanoparticelle CSN-IR806/CB vengono iniettate e, grazie alle loro dimensioni e alla “schermatura” esterna data dal PEG, circolano indisturbate nel sangue per poi accumularsi selettivamente nel tumore (sfruttando il cosiddetto effetto EPR, tipico dei tessuti tumorali). Una volta lì, aspettano il segnale.
Il segnale è la luce nel vicino infrarosso (NIR) a 808 nm. Questa luce, che penetra abbastanza in profondità nei tessuti, attiva la componente IR806 della nanoparticella. E qui inizia lo spettacolo:
- PTT (Terapia Fototermica): L’IR806 assorbe la luce e si scalda, generando un aumento localizzato della temperatura che danneggia le cellule tumorali. Abbiamo visto che le nostre nanoparticelle sono bravissime a farlo, molto più dell’IR806 libero!
- PDT (Terapia Fotodinamica): Contemporaneamente, l’IR806 attivato reagisce con l’ossigeno presente (quel poco che c’è) e produce specie reattive dell’ossigeno (ROS), molecole altamente tossiche per le cellule tumorali.
- Aggravamento dell’Ipossia e Rilascio della Chemio (CT): La PDT consuma l’ossigeno residuo, peggiorando ulteriormente l’ipossia all’interno del tumore. Questo è il segnale che aspettava il nostro “gancio” Azo! In questo ambiente fortemente ipossico, il legame Azo si spezza, liberando il farmaco chemioterapico (CB) proprio dove serve di più.
Il risultato? Un triplice attacco sinergico (PTT-PDT-CT) che colpisce le cellule tumorali da più fronti contemporaneamente, massimizzando l’efficacia terapeutica.
Le Prove sul Campo (o meglio, in Laboratorio e in Vivo)
Ovviamente, non ci siamo fermati alla teoria. Abbiamo testato le nostre nanoparticelle CSN-IR806/CB in lungo e in largo.
- Stabilità e Caratteristiche: Abbiamo confermato che le nanoparticelle sono della dimensione giusta (circa 130-200 nm), hanno una bella forma sferica con una struttura nucleo-guscio visibile al microscopio elettronico, e sono super stabili anche in presenza di siero (simulando il sangue).
- Effetto Fototermico e Fotodinamico: Abbiamo misurato la loro capacità di generare calore e ROS sotto irradiazione NIR, confermando l’efficienza della componente IR806. L’efficienza di conversione fototermica è risultata notevole (33.4%).
- Rilascio Ipossia-Dipendente: Abbiamo simulato l’ambiente ipossico in provetta e visto che, effettivamente, il farmaco CB viene rilasciato in modo controllato al diminuire dell’ossigeno, e le nanoparticelle si “disgregano” come previsto.
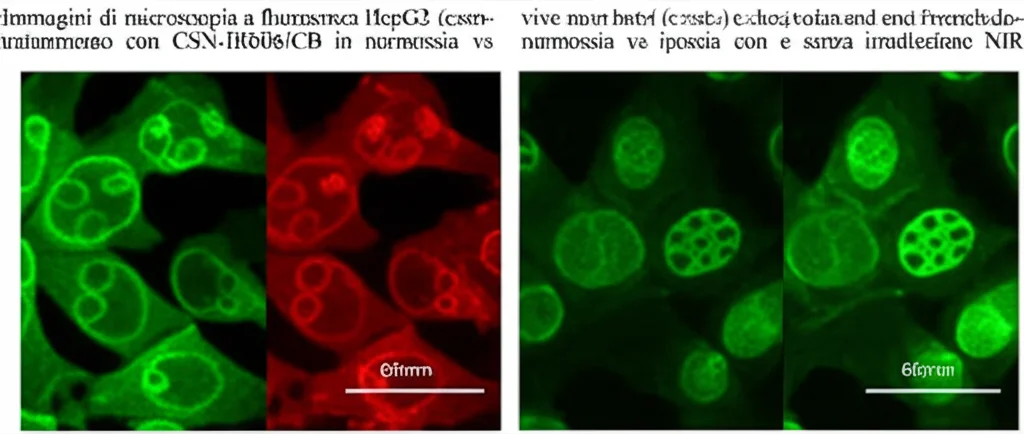
- Test su Cellule Tumorali (In Vitro): Abbiamo trattato diverse linee cellulari tumorali (HepG2, HeLa, MCF-7) con le CSN-IR806/CB. I risultati sono stati chiari: la tossicità era significativamente maggiore in condizioni di ipossia, e diventava devastante combinando ipossia e irradiazione NIR. Le cellule morivano in massa, come confermato anche da test specifici (live/dead staining, misurazione ROS intracellulare). Abbiamo anche visto che le nanoparticelle vengono internalizzate molto bene dalle cellule tumorali. Addirittura, abbiamo osservato segnali che indicano l’attivazione della morte cellulare immunogenica (ICD), un tipo di morte cellulare che può stimolare il sistema immunitario a riconoscere e attaccare il tumore!
Verso l’Applicazione Clinica: i Test su Modelli Animali
Il passo successivo, fondamentale, è stato testare il tutto su modelli animali (topi con tumori umani HepG2).
- Farmacocinetica e Biodistribuzione: Abbiamo visto che le CSN-IR806/CB rimangono in circolo molto più a lungo rispetto all’IR806 libero e si accumulano preferenzialmente nel tumore. Le immagini *in vivo* e *ex vivo* lo hanno confermato: dopo 12-24 ore, la maggior parte del segnale fluorescente (dovuto all’IR806) era concentrato proprio nel tessuto tumorale.
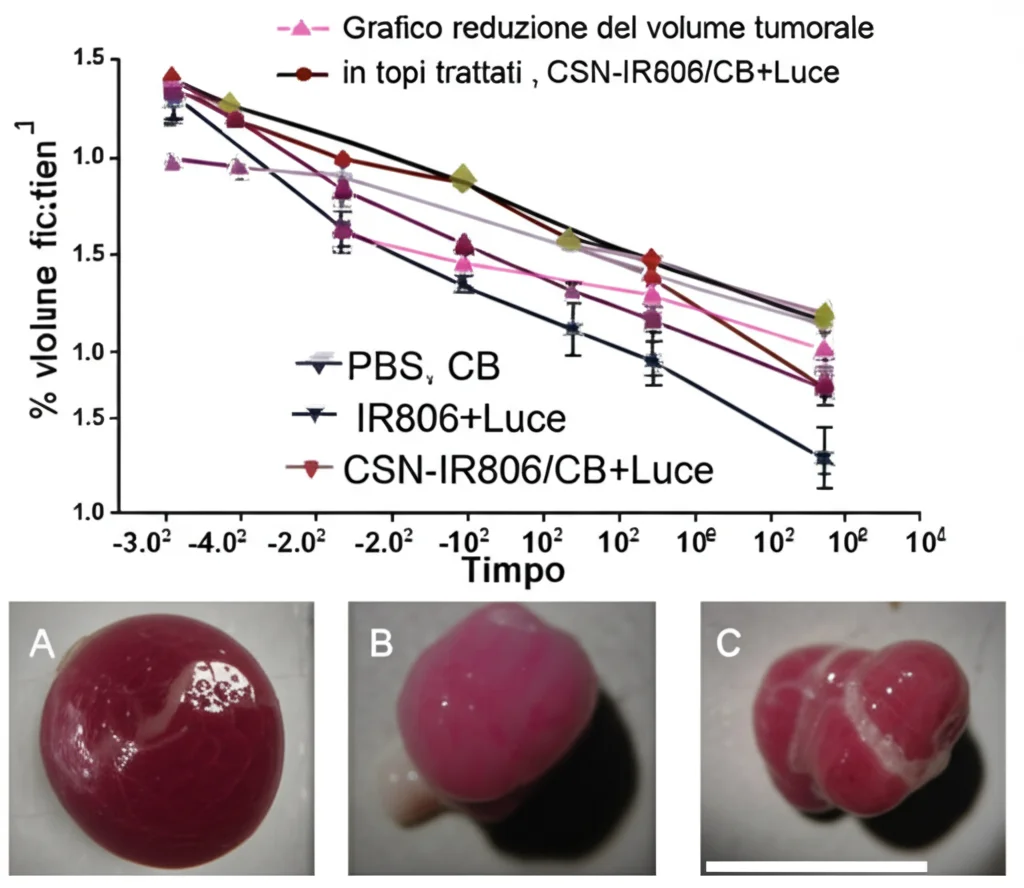
- Efficacia Antitumorale In Vivo: Qui abbiamo avuto le conferme più importanti. I topi trattati con CSN-IR806/CB e irradiazione NIR hanno mostrato una riduzione drastica della crescita tumorale. Il tasso di inibizione tumorale (TIR) ha raggiunto un impressionante 85.4%! Questo risultato è stato nettamente superiore a quello ottenuto con i farmaci liberi o con le nanoparticelle senza irradiazione. Le analisi istologiche sui tumori (HeE, TUNEL, PCNA, HIF-1α) hanno confermato la massiccia necrosi e apoptosi cellulare e la ridotta proliferazione nel gruppo trattato con la nostra strategia combinata.
- Sicurezza: Un aspetto cruciale è la sicurezza. Durante tutto il trattamento, i topi non hanno mostrato perdita di peso significativa né segni di tossicità a livello degli organi principali (come confermato dalle analisi del sangue e dall’istologia degli organi). Questo suggerisce che il nostro approccio è non solo efficace, ma anche ben tollerato.
Cosa Ci Riserva il Futuro?
Insomma, abbiamo sviluppato con successo questo nanoprofarmaco sopramolecolare (CSN-IR806/CB) che sfrutta l’ipossia tumorale e combina tre diverse terapie (PTT, PDT e chemioterapia) in un unico sistema intelligente. La sua stabilità, la capacità di accumularsi nel tumore e il meccanismo di rilascio controllato, uniti all’efficacia sinergica dimostrata sia in vitro che in vivo, lo rendono un candidato davvero promettente per future applicazioni cliniche nel trattamento del cancro.
Certo, la strada è ancora lunga prima di arrivare ai pazienti, ma questi risultati ci danno una grande speranza. Stiamo aprendo la porta a terapie sempre più mirate, efficaci e, speriamo, con minori effetti collaterali. È un campo in continua evoluzione, ed è entusiasmante farne parte!
Fonte: Springer