Nanoparticelle “Intelligenti” che si Scaldano con la Luce: Una Nuova Speranza per la Terapia del Cancro?
Ciao a tutti! Oggi voglio parlarvi di qualcosa di veramente affascinante che sta emergendo dal mondo della ricerca scientifica, qualcosa che potrebbe cambiare il modo in cui affrontiamo alcune malattie, come il cancro. Immaginate di avere delle minuscole particelle, così piccole da essere invisibili a occhio nudo, che possono viaggiare nel corpo, raggiungere un tumore e, una volta lì, “accendersi” con la luce per distruggerlo dall’interno. Sembra fantascienza, vero? Eppure, è proprio quello su cui noi ricercatori stiamo lavorando, e i risultati sono incredibilmente promettenti!
La Sfida: Colpire il Bersaglio Giusto
Uno dei grandi problemi delle terapie antitumorali tradizionali, come la chemioterapia, è che spesso colpiscono non solo le cellule malate, ma anche quelle sane, causando effetti collaterali pesanti. L’ideale sarebbe avere un approccio mirato, capace di agire solo dove serve. Qui entra in gioco la terapia fototermica (PTT). L’idea di base è semplice: iniettare nel corpo sostanze (chiamate cromofori) che assorbono la luce, in particolare quella nel vicino infrarosso (NIR), che può penetrare abbastanza in profondità nei tessuti. Quando queste sostanze vengono illuminate dall’esterno con un laser NIR, assorbono l’energia luminosa e la trasformano in calore. Se questo calore viene generato proprio all’interno del tumore, può letteralmente “cuocere” le cellule cancerose, uccidendole.
Ma non è tutto! Lo stesso principio può essere usato per la diagnostica, con una tecnica chiamata imaging fotoacustico (PAI). In questo caso, l’impulso di calore generato dalla luce provoca una minuscola espansione del tessuto, che crea un’onda sonora (ultrasuono). Captando questi ultrasuoni, possiamo creare immagini dettagliate delle strutture interne del corpo, individuando ad esempio la posizione del tumore con grande precisione. Avere una sostanza che funziona sia per la diagnosi (PAI) che per la terapia (PTT) – un approccio “teranostico” – sarebbe fantastico.
Il Polipirrolo: Un Campione con un Difetto
Tra i materiali che si sono dimostrati ottimi trasformatori di luce in calore c’è il polipirrolo (PPy). È un polimero organico, un semiconduttore, davvero efficiente in questo compito. Il problema? Il PPy “nativo” è un osso duro: non si scioglie praticamente in nessun solvente comune, men che meno in acqua. E per poterlo usare nel corpo umano, la solubilità in acqua e la biocompatibilità sono fondamentali. Finora, si è cercato di aggirare il problema creando nanoparticelle di PPy stabilizzate con altri polimeri, ma spesso queste particelle sono relativamente grandi (decine o centinaia di nanometri).
La Nostra Idea: Nanogabbie Intelligenti
Ed è qui che entra in gioco la nostra idea. E se potessimo creare delle particelle piccolissime, quasi delle “nanogabbie” su misura, capaci di contenere il PPy, renderlo solubile in acqua e, in più, aggiungere una funzionalità “intelligente”? Abbiamo pensato alle nanoparticelle a catena singola (SCNP). Immaginate una lunga catena polimerica che viene fatta ripiegare su se stessa e poi “cucita” internamente per creare una struttura tridimensionale stabile e super piccola, con dimensioni inferiori ai 10 nanometri! Queste SCNP sono così piccole che potrebbero potenzialmente sfruttare l’effetto EPR (Enhanced Permeation and Retention), accumulandosi più facilmente nei tessuti tumorali rispetto a quelli sani, e potrebbero essere eliminate più facilmente dal corpo una volta finito il loro lavoro.

La vera genialata è stata come abbiamo inserito il PPy e aggiunto l’intelligenza. Abbiamo progettato una catena polimerica di base (fatta di OEGMA, un materiale biocompatibile e solubile in acqua) che conteneva già dei piccoli “agganci” di pirrolo. Poi, abbiamo aggiunto altro pirrolo e avviato la sua polimerizzazione (la formazione del PPy) direttamente durante il processo di collasso della catena. In pratica, il PPy si forma all’interno della SCNP mentre questa si crea, fungendo esso stesso da “cucitura” interna (crosslinker). Il risultato? Delle SCNP piccolissime (tra 6.8 e 8.9 nanometri!), perfettamente solubili in acqua, con un cuore di PPy pronto ad assorbire la luce.
Il Tocco “Smart”: La Termoresponsività
Ma non ci siamo fermati qui. Il guscio esterno delle nostre SCNP, fatto di OEGMA, ha una proprietà speciale: è termoresponsivo. Significa che reagisce alla temperatura. In particolare, mostra un comportamento di tipo LCST (Lower Critical Solution Temperature). Sotto una certa temperatura (nel nostro caso, intorno ai 50°C), le SCNP sono felicemente disperse in acqua. Ma se la temperatura supera questa soglia, le catene di OEGMA cambiano conformazione, diventano meno solubili e le SCNP tendono ad aggregarsi tra loro, formando particelle più grandi.
Ora, mettete insieme i pezzi:
1. Le nostre SCNP contengono PPy, che assorbe la luce NIR e genera calore.
2. Il guscio di OEGMA è termoresponsivo e si aggrega sopra i 50°C.
Cosa succede quando illuminiamo le nostre SCNP con luce NIR? Il PPy genera calore, la temperatura locale intorno alla nanoparticella sale… e supera la soglia LCST! Questo fa sì che le SCNP inizino ad aggregarsi proprio lì, nella zona illuminata. È un meccanismo auto-amplificante! Più SCNP si aggregano, più PPy c’è in quella zona, più calore viene generato, e così via. E questo processo è reversibile: quando smettiamo di illuminare e la temperatura scende, le SCNP si disperdono di nuovo.
Alla Prova dei Fatti: Scaldano Davvero!
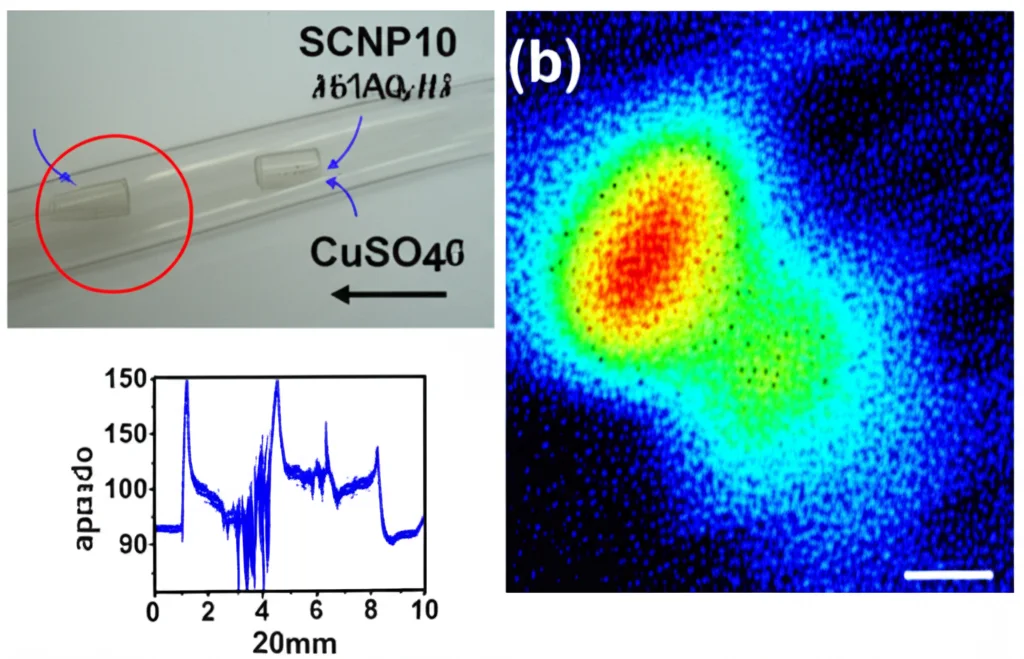
Abbiamo testato le nostre nanoparticelle (in particolare quelle chiamate SCNP10, che contenevano più PPy) in laboratorio. Illuminando soluzioni acquose con un laser a 815 nm, abbiamo visto aumenti di temperatura notevoli, fino a quasi 57°C in più rispetto alla temperatura iniziale! Anche usando un sistema di illuminazione a LED meno potente (a 722 nm), simile a quelli che si potrebbero usare in applicazioni cliniche, abbiamo raggiunto temperature superiori ai 60°C partendo da circa 16°C, dimostrando un’efficienza di conversione luce-calore altissima, fino al 75%. E abbiamo visto chiaramente l’aggregazione indotta dalla luce: la soluzione diventava torbida durante l’irradiazione e tornava limpida raffreddandosi.

Uccidere le Cellule Tumorali: Missione Compiuta?
Il test cruciale era ovviamente vedere se questo calore fosse sufficiente per uccidere le cellule tumorali. Abbiamo usato due tipi di cellule: fibroblasti sani (3T3) e cellule di cancro al colon (DLD-1). Abbiamo trattato le cellule con diverse concentrazioni delle nostre SCNP10 e poi le abbiamo illuminate con i LED NIR per 15 minuti. I risultati sono stati impressionanti. Anche a concentrazioni bassissime di SCNP (appena 0.001 mg/mL) e con un’intensità luminosa moderata (0.84 W/cm²), abbiamo osservato la morte quasi completa di entrambe le linee cellulari dopo 96 ore. Questo dimostra l’incredibile efficacia PTT delle nostre nanoparticelle. Certo, il fatto che uccidano anche le cellule sane è un punto su cui lavorare: serviranno strategie per indirizzare le SCNP specificamente verso il tumore (magari sfruttando proprio l’effetto EPR o legando molecole di targeting alla superficie delle SCNP).
Non Solo Terapia: Un Nuovo Modo di “Vedere”
Come dicevo, queste nanoparticelle funzionano anche per l’imaging fotoacustico (PAI). Abbiamo dimostrato che generano un segnale PAI chiaro e che l’intensità del segnale è proporzionale alla loro concentrazione. Ma la cosa più interessante è che la loro capacità di aggregarsi con il calore offre un meccanismo di contrasto unico. Immaginate di fare un’immagine PAI del tessuto: vedrete un certo segnale dalle SCNP disperse. Poi, le illuminate per scaldarle e farle aggregare, e fate una seconda immagine. Le SCNP aggregate avranno un’efficienza PAI leggermente diversa. Sottraendo le due immagini, possiamo evidenziare specificamente le zone dove sono presenti le nostre nanoparticelle “intelligenti”, distinguendole dal background e da altri eventuali assorbitori. È come avere un interruttore on/off per il contrasto!
Cosa Significa Tutto Questo?
Abbiamo creato delle nanoparticelle piccolissime (<10 nm), biocompatibili e solubili in acqua, che incapsulano il polipirrolo, un potente convertitore di luce in calore. Queste SCNP non solo sono estremamente efficaci nella terapia fototermica, uccidendo cellule tumorali a basse dosi e con poca luce, ma hanno anche una caratteristica unica: rispondono al calore che esse stesse generano aggregandosi in modo reversibile. Questo comportamento foto-termoresponsivo apre scenari affascinanti:
- Effetto auto-amplificante: L’aggregazione indotta dalla luce potrebbe concentrare le nanoparticelle proprio dove serve, potenziando l’effetto terapeutico.
- Clearance facilitata: Le dimensioni ridotte potrebbero permettere una facile eliminazione dal corpo dopo l’uso.
- Nuovo contrasto PAI: La capacità di cambiare stato (disperso/aggregato) offre un modo specifico per visualizzarle nei tessuti.
Certo, la strada verso l’applicazione clinica è ancora lunga, ma questi risultati sono un passo avanti entusiasmante. Stiamo combinando nanotecnologia, chimica dei polimeri e fisica della luce per creare strumenti sempre più intelligenti e mirati nella lotta contro malattie complesse come il cancro. È un campo di ricerca incredibilmente dinamico e promettente, e non vediamo l’ora di scoprire cosa ci riserverà il futuro!
Fonte: Springer







