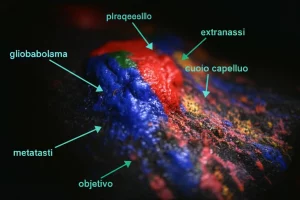
Glioblastoma: Nanoparticelle Spia e Killer per una Terapia Mirata e Guidata dalle Immagini
Ciao a tutti! Oggi voglio parlarvi di una sfida medica enorme, una di quelle che ti tolgono il sonno: il glioblastoma (GBM). È il tumore cerebrale maligno più comune nei giovani adulti e, purtroppo, la prognosi non è delle migliori, con una sopravvivenza media che si aggira intorno ai 15 mesi. Un incubo, vero? Ma la ricerca non si ferma mai, e oggi vi racconto di un approccio super innovativo che sta dando risultati promettenti: l’uso di nanoparticelle teranostiche “intelligenti”.
La Sfida del Glioblastoma: Un Nemico Ostico
Perché il glioblastoma è così difficile da trattare? Ci sono principalmente due grossi ostacoli:
- Le cellule staminali del glioma (GIC): sono cellule tumorali particolarmente resistenti alle terapie tradizionali, come la chemioterapia, e sono le principali responsabili della crescita continua del tumore e delle recidive.
- La barriera emato-encefalica (BBB) e la barriera emato-tumorale (BTB): queste barriere proteggono il nostro cervello, ma allo stesso tempo impediscono alla maggior parte dei farmaci di raggiungere efficacemente il tumore. È come avere una fortezza impenetrabile che protegge il nemico.
Negli anni si sono provate diverse strategie per superare la BBB, come ultrasuoni focalizzati o la somministrazione diretta dei farmaci nel tumore (convection-enhanced delivery, CED). Tuttavia, queste tecniche possono avere effetti collaterali non trascurabili, danneggiando anche il tessuto cerebrale sano. Serviva qualcosa di più mirato, di più “furbo”.
L’Idea Geniale: Nanoparticelle a Doppia Attivazione Enzimatica
Ed è qui che entriamo in gioco noi, o meglio, la nostra idea basata sulle nanotecnologie. Abbiamo pensato: e se potessimo creare dei “nano-agenti” capaci di attivarsi solo nel tumore, colpendo selettivamente le cellule malate e magari aprendo anche un varco nella barriera per far passare meglio la terapia?
Abbiamo sviluppato due tipi di nanoparticelle teranostiche (TNP). “Teranostico” è una parola un po’ complicata che significa semplicemente che queste particelle servono sia per la terapia che per la diagnostica (cioè possiamo vederle con tecniche di imaging come la risonanza magnetica).
Ecco le nostre due “armi segrete”:
- TNP-MMP-14: Questa nanoparticella è progettata per essere attivata da un enzima chiamato MMP-14 (Matrix Metalloproteinase-14), che è molto più abbondante nel glioblastoma rispetto al cervello sano. Una volta attivata, rilascia una sostanza (la colchicina) che agisce come un “grimaldello molecolare”, andando a disturbare i vasi sanguigni del tumore (la BTB), rendendoli più permeabili. L’obiettivo? Aprire la strada ad altre terapie.
- TNP-Cat-B: Questa seconda nanoparticella viene attivata da un altro enzima, la Catepsina-B (Cat-B), anch’essa sovraespressa nel GBM. Quando la Cat-B “taglia” il legame giusto sulla nanoparticella, viene rilasciato un potente farmaco chemioterapico (il Monomethyl auristatin E, o MMAE). Questo farmaco è un inibitore della tubulina, una proteina essenziale per la divisione cellulare, e quindi colpisce e uccide le cellule tumorali, comprese le resistenti GIC.
La nostra ipotesi era che usare queste due nanoparticelle insieme potesse essere una strategia vincente: la prima apre la porta (indebolisce la BTB), la seconda entra e colpisce il bersaglio (uccide le cellule tumorali). Una vera e propria terapia combinata a livello nanoscopico!
Mettiamolo alla Prova: L’Esperimento
Per verificare la nostra idea, abbiamo condotto degli studi su modelli animali (topi) a cui avevamo impiantato cellule di glioblastoma umano (GBM39) che esprimevano luciferasi (per poter monitorare la crescita del tumore con immagini di bioluminescenza, BLI).
Abbiamo diviso gli animali in tre gruppi:
- Gruppo Terapia Combinata: Ha ricevuto prima TNP-MMP-14 (per aprire la barriera) e il giorno dopo TNP-Cat-B (per attaccare il tumore).
- Gruppo Monoterapia: Ha ricevuto solo TNP-Cat-B (due dosi a distanza di 24 ore).
- Gruppo di Controllo: Ha ricevuto una soluzione salina (placebo).
Abbiamo usato la risonanza magnetica (MRI) ad alta risoluzione prima e dopo i trattamenti per “vedere” le nanoparticelle nel tumore. Queste nanoparticelle contengono ossido di ferro, che altera il segnale MRI (in particolare il tempo di rilassamento T2*) dove si accumulano. Un T2* più basso significa più nanoparticelle nel tumore. Abbiamo anche monitorato la crescita del tumore con BLI e, alla fine, abbiamo analizzato i tessuti tumorali al microscopio (istologia) per confermare i risultati.
Cosa Abbiamo Visto: I Risultati (E Sono Emozionanti!)
I risultati sono stati davvero incoraggianti e hanno confermato la nostra ipotesi!
Accumulo delle Nanoparticelle (MRI): La risonanza magnetica ha mostrato chiaramente che nel gruppo della terapia combinata, il segnale T2* del tumore diminuiva molto di più rispetto al gruppo della monoterapia, specialmente dopo la seconda iniezione. Questo significa che grazie all’azione “apriporta” di TNP-MMP-14, le nanoparticelle terapeutiche TNP-Cat-B riuscivano ad accumularsi molto meglio nel tumore. L’analisi istologica con la colorazione Blu di Prussia (che rileva il ferro) ha confermato una presenza significativamente maggiore di ferro (e quindi di nanoparticelle) nei tumori del gruppo combinato.
Efficacia Terapeutica:
- Crescita Tumorale (BLI e Volume MRI): Le immagini di bioluminescenza hanno mostrato una riduzione significativa della “luce” emessa dal tumore (indice di vitalità) solo nel gruppo della terapia combinata dopo 10 giorni. Anche le misurazioni del volume tumorale tramite MRI hanno confermato una tendenza alla riduzione del volume nel gruppo combinato, mentre nei gruppi monoterapia e controllo i tumori continuavano a crescere. La differenza tra combinata e monoterapia/controllo era statisticamente significativa.
- Morte Cellulare (Apoptosi): L’analisi istologica ha rivelato un aumento massiccio di un marcatore di apoptosi (morte cellulare programmata), la Caspase-3 attiva, nei tumori trattati con la terapia combinata. Molto più alta rispetto alla monoterapia e al controllo. Questo ci dice che la combinazione uccideva le cellule tumorali in modo molto più efficace.
- Azione sui Vasi e sulle Cellule Staminali: La terapia combinata ha anche ridotto significativamente la densità dei vasi sanguigni nel tumore (marcatore CD31), coerente con l’azione del farmaco rilasciato da TNP-MMP-14. Ancora più importante, abbiamo visto una riduzione significativa delle cellule GIC (marcatore CD133) nel gruppo combinato, suggerendo che questa strategia potrebbe colpire anche le cellule più resistenti e responsabili delle recidive.
Inoltre, abbiamo verificato che le nostre nanoparticelle erano stabili nelle condizioni fisiologiche e che gli enzimi target (MMP-14 e Cat-B) erano effettivamente sovraespressi nel nostro modello di glioblastoma rispetto al tessuto cerebrale normale, confermando la specificità del nostro approccio. Non abbiamo osservato tossicità significativa negli organi principali, il che è un altro punto a favore.

Perché è Importante e Prossimi Passi
Questo studio è entusiasmante perché dimostra il potenziale di un approccio a doppia attivazione enzimatica per superare due dei maggiori ostacoli nella terapia del glioblastoma: la consegna del farmaco attraverso la barriera emato-tumorale e l’eliminazione delle cellule tumorali resistenti. La capacità di monitorare l’accumulo delle nanoparticelle e l’efficacia della terapia tramite MRI è un vantaggio enorme, perché permette di “vedere” in tempo reale se il trattamento sta funzionando e dove sta agendo, aprendo la strada a terapie sempre più personalizzate.
Certo, siamo ancora in una fase preclinica. Abbiamo usato un solo tipo di linea cellulare di glioblastoma e dovremo confermare questi risultati su altri modelli che riflettano meglio l’eterogeneità di questo tumore. Sarà anche importante ottimizzare i tempi e le dosi della somministrazione e valutare come questa strategia si integra con le terapie standard come la radioterapia o la chemioterapia con temozolomide.
Tuttavia, i risultati sono una solida base di partenza. L’idea di usare enzimi specifici del tumore come “interruttori” per attivare farmaci è potente e potrebbe essere applicata anche ad altri tipi di cancro che sovraesprimono MMP-14 e Cat-B, come alcuni tumori al seno o melanomi.
Insomma, la strada è ancora lunga, ma queste nanoparticelle “spia e killer” ci danno una nuova, affascinante speranza nella lotta contro il glioblastoma. Continueremo a lavorarci con passione!
Fonte: Springer