Nanoparticelle: La Nostra Arma Segreta Contro i Superbatteri Resistenti alla Colistina
Ciao a tutti! Oggi voglio parlarvi di una sfida enorme nel mondo della medicina: i batteri super resistenti agli antibiotici. Immaginate un nemico che diventa sempre più forte, capace di schivare le nostre migliori difese. Tra questi “super cattivi”, ci sono i batteri Gram-negativi resistenti alla colistina. La colistina è un po’ come l’ultima spiaggia, l’antibiotico che usiamo quando nient’altro funziona contro infezioni gravissime. Ma, ahimè, dal 2015 la situazione si è complicata.
Il Problema: Resistenza e Tossicità
Sono comparsi dei geni “furbetti”, chiamati mcr (mobile colistin resistance), che si diffondono rapidamente tra i batteri. Questi geni modificano la “corazza” esterna dei batteri (il lipide A della membrana), rendendo difficile per la colistina attaccarsi e fare il suo lavoro. È come se il nemico avesse cambiato serratura e la nostra chiave (la colistina) non funzionasse più bene. Come se non bastasse, la colistina ha un lato oscuro: può essere tossica per i reni (nefrotossicità) e il sistema nervoso (neurotossicità), e la dose efficace è pericolosamente vicina a quella tossica. Un bel dilemma, vero? Ci troviamo di fronte a una crisi sanitaria globale, e c’è un bisogno disperato di nuove armi o strategie per combattere questi superbatteri e scongiurare un’era “post-antibiotica”.
Una Possibile Soluzione: L’Unione Fa la Forza
Qui entra in gioco un’idea interessante: combinare la colistina con un altro farmaco, la niclosamide. La niclosamide è un farmaco approvato da tempo (dal 1982!) per trattare le infezioni da tenia, ma si è scoperto che ha anche altre proprietà: è attiva contro virus (come il SARS-CoV) e contro altri batteri, inclusi alcuni Gram-positivi e persino l’Helicobacter pylori. Studi in laboratorio (in vitro) hanno mostrato che, insieme, colistina e niclosamide funzionano in modo sinergico contro i batteri Gram-negativi resistenti alla colistina. Sembra che la niclosamide possa addirittura ridurre la tossicità renale della colistina e agire come un “guardiano”, impedendo ai batteri di espellere la colistina grazie a delle pompe speciali (pompe di efflusso). Insomma, un’accoppiata promettente!
La Sfida della Consegna
Ma c’è un “ma”. Colistina e niclosamide sono molto diverse tra loro, soprattutto per come si comportano nel corpo (farmacocinetica). La colistina è più “amica” dell’acqua (idrofila), mentre la niclosamide preferisce i grassi (idrofoba). Se le iniettiamo semplicemente insieme, è difficile garantire che arrivino entrambe nel posto giusto (il sito dell’infezione) nelle quantità giuste e nello stesso momento per poter collaborare efficacemente. E poi, c’è sempre la preoccupazione che la combinazione possa aumentare la tossicità. Come fare, allora, a farle lavorare insieme nel corpo umano in modo sicuro ed efficace?
La Nostra Idea Geniale: Le Nanoparticelle!
Ed ecco dove entra in campo la nostra ricerca! Abbiamo pensato: e se creassimo un “veicolo” speciale, microscopico, capace di trasportare entrambi i farmaci direttamente dove servono? Abbiamo progettato e realizzato delle nanoparticelle utilizzando un copolimero anfifilico chiamato mPEG-PLGA. Non spaventatevi per il nome! Pensatelo come un materiale “intelligente”: una parte (mPEG) ama l’acqua, l’altra (PLGA) ama i grassi. Questo materiale è fantastico perché è biodegradabile e biocompatibile, tanto che è già approvato dalla FDA (l’ente americano per i farmaci) per uso medico. Può formare delle minuscole sfere (nanoparticelle, appunto) con un nucleo e un guscio.
Usando una tecnica chiamata “doppia emulsificazione” (un po’ come fare una maionese molto, molto sofisticata!), siamo riusciti a caricare la colistina (idrofila) nel nucleo acquoso e la niclosamide (idrofoba) nello strato più oleoso del guscio. Il risultato? Le nostre nanoparticelle COL/NIC-mPEG-PLGA-NPs: piccoli “pacchetti” che contengono entrambi i farmaci, pronti per la missione!

Abbiamo lavorato sodo per ottimizzare la ricetta di queste nanoparticelle, usando anche software avanzati (Design-Expert e il metodo Box-Behnken) per trovare le condizioni perfette di preparazione: la giusta concentrazione di mPEG-PLGA, il rapporto ideale tra i solventi e la quantità ottimale di un agente stabilizzante (PVA). Siamo riusciti a ottenere nanoparticelle con un’alta efficienza di caricamento per entrambi i farmaci (circa 89% per la niclosamide e 77% per la colistina).
Caratteristiche delle Nostre Nanoparticelle
Le nostre COL/NIC-mPEG-PLGA-NPs sono risultate essere sferette piccolissime (circa 170 nanometri di diametro – per darvi un’idea, un capello umano è largo circa 80.000 nanometri!), con una superficie quasi neutra. Questa caratteristica è importante perché le aiuta a non essere riconosciute e distrutte troppo presto dal sistema immunitario e a circolare più a lungo nel sangue. Le analisi (come la microscopia elettronica a trasmissione TEM e la spettroscopia FTIR) hanno confermato la struttura core-shell e che entrambi i farmaci erano stati caricati con successo senza alterare la struttura base del polimero.
Un altro aspetto fondamentale è la stabilità. Le nostre nanoparticelle, una volta liofilizzate (cioè private dell’acqua per conservarle meglio, usando il saccarosio come protettore), si sono mantenute stabili a 4°C per almeno due mesi, senza cambiare forma o dimensione. Sono rimaste stabili anche in diversi liquidi che simulano le condizioni del corpo (acqua, soluzione salina PBS, fluidi gastrici e intestinali simulati), il che è ottimo per un’eventuale somministrazione sistemica. Inoltre, rilasciano i farmaci in modo controllato e prolungato nel tempo, il che potrebbe significare un effetto terapeutico più duraturo.
Test in Laboratorio: Funzionano!
Abbiamo messo alla prova le nostre nanoparticelle contro diversi ceppi batterici Gram-negativi resistenti alla colistina (Salmonella, E. coli, K. pneumoniae) isolati da pazienti. I risultati sono stati entusiasmanti! Le COL/NIC-mPEG-PLGA-NPs hanno mostrato un’eccellente attività antibatterica, riducendo drasticamente la crescita batterica (oltre 1000 volte!) rispetto ai controlli o ai farmaci usati singolarmente o in combinazione libera (non incapsulati). Le immagini al microscopio (colorazione LIVE/DEAD e SEM) hanno confermato che le nanoparticelle danneggiavano significativamente la membrana dei batteri, portandoli alla lisi (cioè alla rottura). Questo dimostra che il nostro sistema non solo funziona, ma potenzia l’effetto dei farmaci contro i batteri resistenti.

Come Funzionano? Sveliamo il Meccanismo
Ma come fanno esattamente le nostre nanoparticelle a superare la resistenza? Abbiamo indagato più a fondo usando un ceppo di E. coli resistente come modello. Abbiamo scoperto un meccanismo d’azione affascinante in tre fasi:
- Adesione e Permeabilizzazione: Le nanoparticelle, grazie al rivestimento in mPEG-PLGA, si attaccano più facilmente alla superficie dei batteri resistenti. Questo primo contatto aumenta la permeabilità della membrana batterica esterna e ne disturba il potenziale elettrico (un po’ come creare delle piccole falle nella loro difesa).
- Rilascio e Attacco: Una volta attaccate, le nanoparticelle rilasciano la colistina, che può così interagire meglio con la membrana batterica (nonostante la resistenza) e danneggiarla ulteriormente, rendendola ancora più “permeabile”.
- Colpo di Grazia Interno: La membrana danneggiata permette a più colistina e, soprattutto, alla niclosamide di entrare nella cellula batterica. Qui, la niclosamide gioca un ruolo chiave: inibisce le “pompe di efflusso” (quelle che i batteri usano per buttare fuori i farmaci), intrappolando di fatto entrambi gli antibiotici all’interno. Questo porta a una riduzione della produzione di energia (ATP) e a un aumento dello stress ossidativo (accumulo di specie reattive dell’ossigeno, ROS), che alla fine uccide il batterio resistente. Abbiamo confermato l’importanza dello stress ROS vedendo che l’attività antibatterica diminuiva se aggiungevamo un antiossidante.
Sicurezza Prima di Tutto
Un aspetto cruciale era verificare la sicurezza delle nostre nanoparticelle. I test in vitro hanno mostrato che non danneggiano i globuli rossi (nessuna emolisi significativa) e non sono tossiche per le cellule renali (PK-15) o per i macrofagi (RAW 264.7) a concentrazioni efficaci contro i batteri, e anche a dosi molto più alte. Ancora più importante, nei test su animali (topi), abbiamo osservato che il trattamento con le nostre nanoparticelle ha causato meno danni a fegato e reni rispetto alla somministrazione di colistina libera. I livelli dei biomarcatori di danno epatico (ALT, AST) e renale (BUN, CREA) erano significativamente più bassi nei topi trattati con le nanoparticelle. Questo suggerisce che incapsulare la colistina e la niclosamide in questo modo non solo migliora l’efficacia ma riduce anche la temuta tossicità della colistina!
Le Nanoparticelle Vanno a Segno
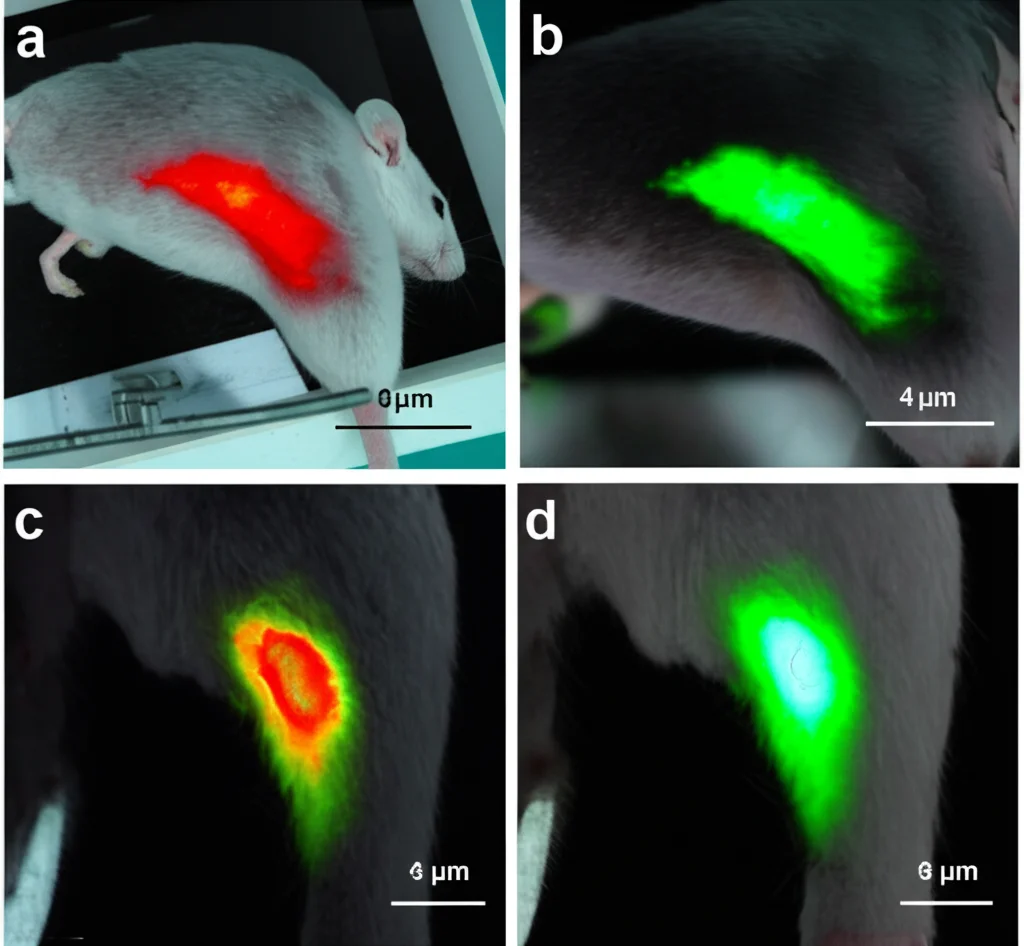
Ma le nanoparticelle arrivano davvero dove serve? Abbiamo condotto studi di biodistribuzione nei topi, marcando le nanoparticelle con un colorante fluorescente (DiR) per poterle “vedere” all’interno del corpo con una speciale telecamera (IVIS). Abbiamo visto che, dopo iniezione endovenosa, le nanoparticelle si distribuivano principalmente nel fegato e nella milza (organi coinvolti nel metabolismo), ma quando abbiamo creato un’infezione localizzata in una coscia del topo, le nanoparticelle si sono accumulate preferenzialmente nel sito infetto rispetto al sito sano. Questo effetto “targeting” verso l’infiammazione è molto promettente, perché significa che i farmaci vengono concentrati proprio dove c’è l’infezione.
La Prova del Nove: Il Modello Animale di Infezione
Infine, abbiamo testato l’efficacia terapeutica delle nostre COL/NIC-mPEG-PLGA-NPs in un modello animale più realistico: una peritonite-sepsi (un’infezione grave della cavità addominale che si diffonde nel sangue) indotta in topi con E. coli resistente alla colistina. I risultati sono stati davvero incoraggianti!
- Sopravvivenza: I topi trattati con le nostre nanoparticelle (specialmente a dose media) hanno mostrato un tasso di sopravvivenza significativamente più alto (75%) rispetto ai topi non trattati (0% sopravvissuti) o a quelli trattati con i farmaci liberi, sia singolarmente (circa 40% sopravvissuti) che in combinazione (50% sopravvissuti).
- Carica Batterica: Dopo 24 ore, i topi trattati con le nanoparticelle avevano una quantità di batteri drasticamente ridotta nel fluido peritoneale e negli organi principali (fegato, milza, reni) rispetto agli altri gruppi.
- Infiammazione: I livelli di citochine pro-infiammatorie (IL-6, IL-1β, TNF-α) nel sangue erano significativamente più bassi nei topi trattati con le nanoparticelle. Anche l’analisi dei tessuti (istologia) ha mostrato una netta riduzione dell’infiammazione e del danno tissutale (meno cellule infiammatorie, meno necrosi, meno vacuoli) negli organi dei topi trattati con il nostro nanosistema.
Questi risultati in vivo dimostrano che le nostre nanoparticelle non solo funzionano sulla carta o in provetta, ma sono efficaci nel trattare un’infezione grave causata da batteri resistenti in un organismo vivente, riducendo la mortalità, l’infezione e l’infiammazione.
Conclusioni e Prospettive Future
In sintesi, siamo riusciti a sviluppare un nanosistema basato su mPEG-PLGA capace di co-veicolare colistina e niclosamide, due farmaci con proprietà molto diverse. Questo sistema si è dimostrato efficace nel superare la resistenza alla colistina in batteri clinicamente rilevanti, agendo attraverso un meccanismo multiplo che potenzia l’azione dei farmaci e sfrutta le vulnerabilità dei batteri. Cosa ancora più importante, le nanoparticelle sono risultate biocompatibili e hanno mostrato un’eccellente efficacia terapeutica in un modello di infezione grave, riducendo al contempo la tossicità associata alla colistina.
Crediamo che questo approccio basato sulle nanotecnologie abbia un grande potenziale per combattere le infezioni da batteri multi-resistenti. È un passo avanti significativo che apre la strada a nuove strategie terapeutiche per affrontare una delle più grandi minacce alla salute globale. Certo, la strada verso l’applicazione clinica è ancora lunga, ma i risultati sono estremamente promettenti e ci danno speranza nella lotta contro i superbatteri!
Fonte: Springer