Nanofiori Spazzini: Come l’Ossido di Stagno Pulisce le Acque dal Cadmio!
Ciao a tutti! Oggi voglio parlarvi di un problema serio ma anche di una soluzione affascinante che arriva direttamente dal mondo delle nanotecnologie. Sto parlando dell’inquinamento da cadmio, un metallo pesante davvero antipatico che può finire nelle nostre acque a causa di attività industriali come l’estrazione mineraria, la produzione di batterie, fertilizzanti e molto altro. Il cadmio non scherza: è tossico per reni, ossa, sistema respiratorio e riproduttivo, ed è pure classificato come potenziale cancerogeno. L’Organizzazione Mondiale della Sanità (OMS) raccomanda un limite bassissimo nell’acqua potabile (0.003 ppm), quindi capite bene quanto sia cruciale trovare modi efficaci per rimuoverlo.
Esistono diverse tecniche per trattare le acque contaminate, come la precipitazione, l’osmosi inversa, la bioremediation… ma una delle più promettenti, per semplicità, costi e potenziale su larga scala, è l’adsorbimento. Immaginate delle minuscole “spugne” capaci di catturare selettivamente le molecole inquinanti. E qui entrano in gioco i nostri protagonisti: i nanofiori di ossido di stagno (SnO₂).
Perché proprio l’Ossido di Stagno a forma di Fiore?
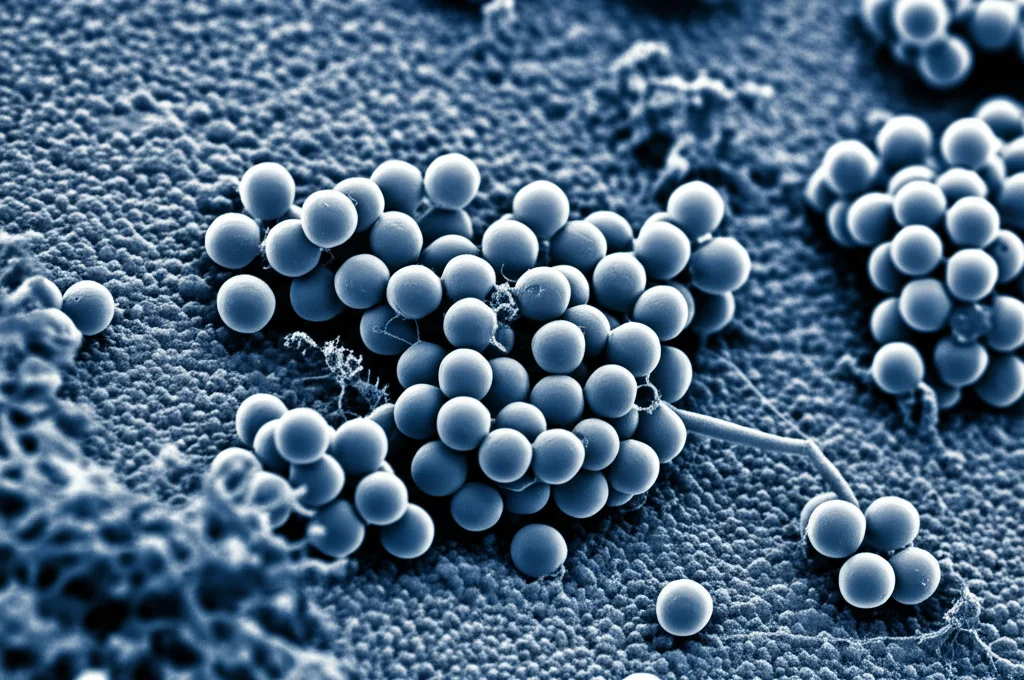
Abbiamo deciso di esplorare le potenzialità dell’ossido di stagno (SnO₂) per una serie di ottime ragioni. Questo materiale, sotto forma di nanoparticelle, ha proprietà uniche: una struttura porosa, stabilità termica, è relativamente economico, biocompatibile e abbondante. Ma la cosa più intrigante è che siamo riusciti a sintetizzarlo, con un metodo semplice ed ecologico (idrotermale), dandogli una forma particolare, simile a quella di un fiore! Questa morfologia “a fiore” non è solo bella da vedere al microscopio elettronico (SEM), ma è funzionale: aumenta enormemente la superficie specifica disponibile per “acchiappare” il cadmio.
Abbiamo caratterizzato a fondo questi nanofiori usando tecniche come la Spettroscopia Infrarossa a Trasformata di Fourier (FTIR), la Diffrazione a Raggi X (XRD) e l’analisi dell’area superficiale BET. I risultati hanno confermato la struttura desiderata (tetragonale tipo rutilo), la purezza e un’area superficiale interessante (31.31 m²/g), oltre alla presenza di gruppi funzionali sulla superficie (come gruppi ossidrile -OH) che sono fondamentali per legare gli ioni metallici.
Ottimizzare la Cattura: Trovare la Ricetta Perfetta
Una volta creati i nostri nanofiori “spazzini”, dovevamo capire come usarli al meglio. Non basta buttarli nell’acqua e sperare. Bisogna trovare le condizioni operative ideali. Per farlo, abbiamo usato un approccio statistico avanzato chiamato Metodologia della Superficie di Risposta (RSM) con un disegno sperimentale Box-Behnken (BBD). Sembra complicato, ma in pratica ci ha permesso di studiare l’effetto combinato di tre fattori chiave con un numero ridotto di esperimenti:
- Il pH della soluzione (quanto acida o basica è l’acqua)
- Il tempo di contatto (quanto tempo lasciamo agire i nanofiori)
- La quantità di nanofiori (la dose di adsorbente)
Dopo una serie di test in batch (cioè in contenitori chiusi, agitando la soluzione), analizzando i risultati con modelli matematici, abbiamo trovato la combinazione vincente! Le condizioni ottimali per massimizzare la rimozione del cadmio da acque reflue sintetiche (create in laboratorio per simulare quelle reali) sono risultate essere: un pH di 9.0 (ambiente leggermente basico), un tempo di agitazione di soli 20 minuti e una quantità di adsorbente di 15 mg per il volume trattato.
E i risultati? Strepitosi! In queste condizioni, i nostri nanofiori di SnO₂ hanno raggiunto un’efficienza di rimozione massima del 99.14 ± 0.10%. Praticamente, hanno ripulito quasi tutto il cadmio presente!

Come Avviene la Magia? Isoterme e Cinetica di Adsorbimento
Ok, funziona alla grande, ma come funziona esattamente? Per capirlo, abbiamo studiato due aspetti fondamentali: le isoterme e la cinetica di adsorbimento.
Le isoterme di adsorbimento ci dicono quanta sostanza (il cadmio, nel nostro caso) si lega all’adsorbente (i nanofiori) quando il sistema raggiunge l’equilibrio, a temperatura costante. Abbiamo testato diversi modelli matematici (Langmuir, Freundlich, Temkin, Dubinin-Radushkevich, Sips, Toth) confrontandoli con i dati sperimentali ottenuti a diverse concentrazioni iniziali di cadmio. Usando un’analisi non lineare (più accurata), abbiamo visto che il modello di Sips era quello che descriveva meglio il processo (con un R² di 0.9894). Questo modello è interessante perché combina le caratteristiche del modello di Langmuir (che ipotizza un adsorbimento a singolo strato su una superficie omogenea) e di Freundlich (che ipotizza un adsorbimento multistrato su una superficie eterogenea). Il fatto che Sips funzioni bene suggerisce che la superficie dei nostri nanofiori è eterogenea, con siti di legame diversi, e che l’adsorbimento avviene sia come singolo strato che potenzialmente in più strati. Da questo modello abbiamo anche calcolato la capacità massima di adsorbimento teorica: ben 57.12 mg di cadmio per grammo di nanofiori! Un valore molto competitivo rispetto ad altri materiali adsorbenti studiati in letteratura.
La cinetica di adsorbimento, invece, ci dice quanto velocemente avviene il processo. Abbiamo seguito la rimozione del cadmio nel tempo e analizzato i dati con modelli cinetici (pseudo-primo ordine, pseudo-secondo ordine, diffusione intraparticellare di Weber-Morris). Anche qui, l’analisi non lineare ha mostrato che il modello pseudo-secondo ordine (PSO) era il migliore (R² di 0.86). Questo modello solitamente indica che il meccanismo limitante la velocità del processo è la chemiadsorbimento, cioè la formazione di legami chimici tra il cadmio e la superficie dei nanofiori. È un legame più forte rispetto alla semplice attrazione fisica (fisisorbimento). Abbiamo anche visto che la diffusione del cadmio all’interno dei pori dei nanofiori (diffusione intraparticellare) contribuisce al processo, ma non è l’unico fattore che ne determina la velocità complessiva. L’energia libera media calcolata dal modello D-R (17.8 kJ/mol) ha ulteriormente supportato l’ipotesi di chemiadsorbimento.
Caratterizzazione e pH: Perché Funziona Meglio in Basico?
Un aspetto cruciale che abbiamo indagato è il punto di carica zero (pHPZC) dei nostri nanofiori. È il valore di pH al quale la superficie del materiale non ha una carica netta. Abbiamo scoperto che per i nostri nanofiori di SnO₂, il pHPZC è circa 5.8. Questo significa che:
- A pH inferiori a 5.8 (ambiente acido), la superficie dei nanofiori è carica positivamente. Poiché anche gli ioni cadmio (Cd²⁺) sono positivi, si respingono, e l’adsorbimento è sfavorito.
- A pH superiori a 5.8 (ambiente basico), la superficie diventa carica negativamente. Questa carica negativa attrae fortemente gli ioni cadmio positivi, favorendo l’adsorbimento.
Ecco spiegato perché abbiamo ottenuto i migliori risultati a pH 9.0! A pH molto più alti si rischierebbe la precipitazione del cadmio come idrossido (Cd(OH)₂), ma a pH 9.0 questo fenomeno era minimo (circa 10%) e l’adsorbimento era dominante.
Posso Riutilizzarli? La Sfida della Rigenerazione
Un aspetto fondamentale per rendere un processo di adsorbimento sostenibile ed economico è la possibilità di riutilizzare l’adsorbente. Abbiamo testato anche questo! Dopo un ciclo di adsorbimento nelle condizioni ottimali, abbiamo separato i nanofiori “carichi” di cadmio, li abbiamo lavati e poi trattati con una soluzione di acido nitrico (HNO₃ 0.1 M) per “staccare” il cadmio catturato e rigenerare la superficie.
Ebbene, abbiamo ripetuto questo processo per quattro cicli consecutivi. Il risultato? L’efficienza di rimozione del cadmio è rimasta incredibilmente alta, sempre superiore al 99% in tutti e quattro i cicli! Questo dimostra l’ottima stabilità e riutilizzabilità dei nostri nanofiori di SnO₂, un vantaggio enorme per potenziali applicazioni pratiche.
In Conclusione: Un Futuro più Pulito con i Nanofiori?
Questo studio ci ha mostrato qualcosa di davvero entusiasmante: i nanofiori di ossido di stagno, sintetizzati con un metodo semplice ed eco-friendly, sono degli adsorbenti estremamente efficaci e rapidi per rimuovere il cadmio dalle acque contaminate. Abbiamo ottimizzato il processo, capito i meccanismi alla base dell’adsorbimento (una combinazione di adsorbimento su superficie eterogenea guidato principalmente da legami chimici) e dimostrato che possono essere rigenerati e riutilizzati più volte senza perdere efficacia.
La loro elevata capacità di adsorbimento (57.12 mg/g), la rapidità d’azione (solo 20 minuti), il basso costo potenziale e la buona riutilizzabilità li rendono candidati ideali per sviluppare sistemi di trattamento delle acque reali, offrendo un’alternativa ecologica ed economica ai metodi tradizionali. Certo, la ricerca deve continuare, magari esplorando come funzionalizzare ulteriormente la superficie per migliorare ancora le prestazioni o testando la rimozione di altri metalli pesanti. Ma la strada intrapresa sembra davvero promettente per contribuire a un futuro con acque più pulite per tutti noi!

Fonte: Springer







