Nano-Conversione Biochimica: Trasformo Farmaci Dentro il Tumore!
Ciao a tutti! Oggi voglio parlarvi di qualcosa che mi entusiasma da matti nel campo della lotta contro il cancro. Sappiamo tutti quanto sia difficile questa battaglia, e uno dei problemi principali delle chemioterapie classiche, come quelle basate su farmaci potenti come il Docetaxel (DTX) e il Paclitaxel (PTX), sono gli effetti collaterali. Questi farmaci sono dei veri guerrieri, ma a volte colpiscono un po’ alla cieca, danneggiando anche le cellule sane e causando tossicità pesanti per i pazienti.
E se potessimo rendere questi guerrieri più intelligenti? Se potessimo far sì che agiscano solo dove serve, cioè dentro il tumore, e magari… trasformarli in qualcosa di ancora più efficace proprio lì, sul campo di battaglia? Sembra fantascienza, vero? Eppure, è proprio quello che stiamo esplorando con una nuova tecnologia affascinante che abbiamo chiamato nano-conversione biochimica.
Ecco l’Idea: la Nano-Conversione Specifica per il Tumore
L’idea di base è geniale nella sua logica. Abbiamo preso il Docetaxel (DTX), un farmaco noto ma, come detto, con i suoi limiti di specificità. Lo abbiamo “vestito” chimicamente con un piccolo peptide (una catena corta di amminoacidi) chiamato (Ac)FRRF. Questo peptide ha due caratteristiche fantastiche:
- Rende la molecola complessiva capace di auto-assemblarsi in nanoparticelle quando si trova in ambiente acquoso (come il nostro sangue). Immaginate tante piccole sfere nanoscopiche che trasportano il farmaco.
- Contiene una sequenza specifica (Arg-Arg o RR) che viene riconosciuta e tagliata da un enzima chiamato Cathepsina B.
E qui viene il bello: la Cathepsina B è un enzima che si trova in abbondanza proprio nell’ambiente tumorale, molto più che nei tessuti sani. Quindi, cosa succede? Le nostre nanoparticelle, chiamiamole (Ac)FRRF-DTX NPs, viaggiano nel corpo, si accumulano preferenzialmente nel tumore (grazie anche a un fenomeno noto come effetto EPR, che sfrutta la “permeabilità” dei vasi sanguigni tumorali) e, una volta lì, incontrano la Cathepsina B.
L’enzima taglia il peptide nel punto giusto. Ma attenzione, non stiamo semplicemente “liberando” il DTX originale come farebbe un classico profarmaco. No, il taglio specifico e la struttura che abbiamo progettato fanno sì che il DTX si trasformi chimicamente in una nuova molecola, che abbiamo chiamato PTXm (Paclitaxel-mimic). Questa PTXm è molto simile al Paclitaxel (PTX), un altro potente farmaco antitumorale, e ne mima l’attività citotossica.
In pratica, abbiamo creato un sistema dove un farmaco (DTX) viene trasportato in forma di nanoparticella fino al tumore e lì, grazie a un segnale biochimico specifico (l’enzima Cathepsina B), si converte in un altro farmaco attivo (PTXm). È una vera e propria nano-conversione biochimica tumore-specifica!

Come Funziona Questa Magia Nanotecnologica?
Prima di buttarci nei test biologici, abbiamo voluto capire meglio queste nanoparticelle. Grazie a simulazioni al computer (in silico), abbiamo visto come le molecole di (Ac)FRRF-DTX, essendo anfifiliche (con una parte che ama l’acqua e una che la odia), tendano spontaneamente a raggrupparsi in acqua formando delle nanoparticelle stabili, con la parte idrofobica (DTX) nascosta all’interno e quella idrofilica (il peptide) esposta all’esterno. Questo è fondamentale per la solubilità e la stabilità nel sangue.
Le simulazioni ci hanno anche mostrato che la molecola PTXm, quella che si forma dopo il taglio enzimatico, ha una struttura e proprietà elettroniche molto simili al Paclitaxel (PTX) “vero”, suggerendo che possa legarsi ai microtubuli (le strutture interne che le cellule usano per dividersi) in modo simile, bloccando così la proliferazione delle cellule tumorali.
Poi siamo passati al laboratorio. Abbiamo sintetizzato il coniugato (Ac)FRRF-DTX e confermato che si auto-assembla in nanoparticelle di circa 230 nanometri, una dimensione adatta per l’accumulo nei tumori. Queste nanoparticelle sono risultate molto più solubili in acqua rispetto al DTX o al PTX da soli (che sono notoriamente poco solubili) e stabili per giorni.
Abbiamo quindi testato la nano-conversione: mettendo le nanoparticelle a contatto con l’enzima Cathepsina B, abbiamo visto (tramite tecniche come HPLC e LC-MS) che nel tempo la quantità di (Ac)FRRF-DTX diminuiva mentre compariva e aumentava quella di PTXm. Senza l’enzima, non succedeva nulla. La conversione specifica funzionava!
Prove di Laboratorio: Funziona Davvero Contro il Cancro?
Ok, le nanoparticelle si formano, sono stabili e si convertono come previsto. Ma uccidono le cellule tumorali? Abbiamo testato la loro efficacia su diverse linee cellulari tumorali, in particolare sulle cellule di carcinoma epatocellulare (Hep G2), che esprimono alti livelli di Cathepsina B.
I risultati sono stati molto incoraggianti! Le nanoparticelle (Ac)FRRF-DTX NPs hanno mostrato una citotossicità significativamente maggiore rispetto al DTX o al PTX usati da soli (soprattutto a concentrazioni più alte, dove la scarsa solubilità dei farmaci liberi limita la loro azione se non si usa DMSO). La PTXm generata si è dimostrata anch’essa molto tossica per le cellule tumorali, con un’efficacia paragonabile a quella delle nanoparticelle stesse a certe concentrazioni. È importante notare che il peptide da solo ((Ac)FRRF) o il DTX senza il gruppo Boc protettivo (de-Boc-DTX) erano molto meno tossici.
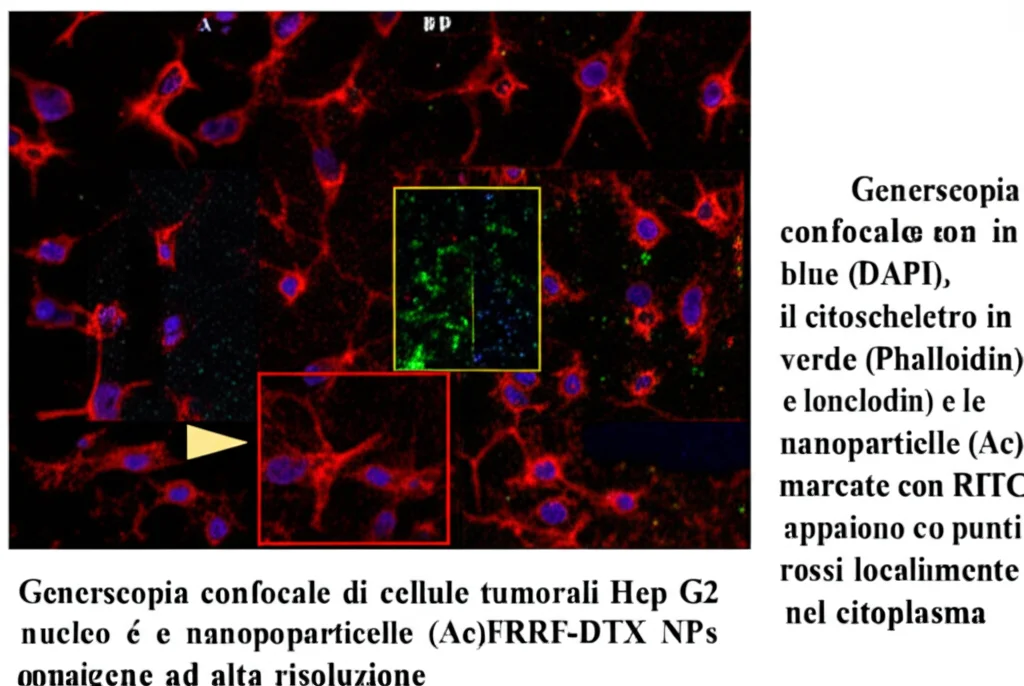
Abbiamo anche visualizzato cosa succede dentro le cellule. Usando dei traccianti fluorescenti, abbiamo visto che le cellule Hep G2 “assorbono” molto bene le nostre nanoparticelle (più del PTX libero), e che queste si localizzano principalmente nel citoplasma. E cosa fanno lì? Esattamente quello che speravamo: interferiscono con la formazione dei microtubuli, proprio come fa il Paclitaxel. Abbiamo visto chiaramente che le cellule trattate con le nanoparticelle (o con PTXm e PTX come controllo) avevano una struttura dei microtubuli completamente disorganizzata rispetto alle cellule non trattate. Questo conferma che la PTXm generata dalla nano-conversione è biologicamente attiva e colpisce il bersaglio giusto.
Il Test sul Campo: Cosa Succede negli Organismi Viventi?
I risultati in vitro erano ottimi, ma la vera prova del nove è sempre l’organismo vivente (in vivo). Abbiamo quindi usato modelli animali (topi) in cui avevamo impiantato tumori umani (Hep G2).
Prima di tutto, abbiamo verificato la biodistribuzione: dove vanno a finire le nanoparticelle una volta iniettate nel sangue? Marcandole con un colorante fluorescente (RITC), abbiamo visto che le (Ac)FRRF-DTX NPs si accumulavano selettivamente nel tessuto tumorale già dopo poche ore dall’iniezione e vi rimanevano per un tempo prolungato (fino a 48 ore), molto più di quanto facesse il de-Boc-DTX marcato. Non solo, le nanoparticelle rimanevano in circolo nel sangue più a lungo, aumentando le possibilità di raggiungere il tumore. Questo è un vantaggio enorme dato dalla struttura nanoparticellare e dalla maggiore solubilità.
E l’efficacia antitumorale? Qui i risultati sono stati davvero notevoli. Abbiamo trattato i topi con tumore iniettando loro soluzione salina (controllo), PTX, de-Boc-DTX, o le nostre nanoparticelle (Ac)FRRF-DTX NPs a intervalli regolari per 17 giorni. Mentre i gruppi trattati con PTX e de-Boc-DTX mostravano una certa riduzione della crescita tumorale rispetto al controllo (circa dimezzata), il gruppo trattato con le nostre nanoparticelle ha mostrato una soppressione quasi totale della crescita tumorale! Alla fine dell’esperimento, i tumori in questo gruppo erano piccolissimi, circa un trentesimo rispetto al gruppo di controllo e significativamente più piccoli anche rispetto ai gruppi trattati con i farmaci standard.
Abbiamo confermato questi risultati analizzando i tumori espiantati: quelli trattati con (Ac)FRRF-DTX NPs erano molto più piccoli e leggeri, e le analisi istologiche (colorazioni HeE, Ki-67 per la proliferazione, TUNEL per la morte cellulare programmata/apoptosi) hanno mostrato una massiccia morte cellulare e una bassissima proliferazione rispetto agli altri gruppi.
Infine, la sicurezza. Uno dei grandi obiettivi era ridurre la tossicità sistemica. Durante l’esperimento, i topi trattati con le nanoparticelle non hanno mostrato perdite di peso significative o segni evidenti di malessere. Le analisi del sangue e l’esame istologico degli organi principali (cuore, fegato, milza, polmoni, reni) alla fine del trattamento non hanno rivelato tossicità rilevanti associate alle (Ac)FRRF-DTX NPs, a differenza di alcuni effetti noti per il PTX su certi parametri ematici (come i neutrofili) che nel nostro caso non si sono verificati. Sembra quindi che la strategia di nano-conversione non solo aumenti l’efficacia, ma riduca anche gli effetti collaterali.
Perché Questa Scoperta è Così Emozionante?
Quello che abbiamo dimostrato qui è un concetto nuovo e potente: la nano-conversione biochimica. Non stiamo solo usando nanoparticelle per trasportare meglio un farmaco (come fanno molte nanomedicine), ma stiamo sfruttando l’ambiente tumorale stesso per trasformare il farmaco in un’altra molecola attiva, potenziandone l’effetto e la specificità.
I vantaggi sono molteplici:
- Maggiore solubilità e stabilità del farmaco grazie alla formulazione in nanoparticelle.
- Accumulo mirato nel tumore (targeting passivo e forse attivo grazie al peptide).
- Attivazione/Conversione specifica nel sito tumorale grazie all’enzima Cathepsina B.
- Elevata efficacia antitumorale, superiore ai farmaci convenzionali nel modello testato.
- Ridotta tossicità sistemica, come suggerito dai dati preliminari di sicurezza.
Questa tecnologia apre scenari incredibili per lo sviluppo di nuovi farmaci antitumorali. Potremmo applicare questo concetto di nano-conversione ad altri farmaci, magari combinando diverse molecole o usando peptidi sensibili ad altri enzimi specifici del tumore. È un esempio brillante di come la chimica, la biologia e le nanotecnologie possano unirsi per creare soluzioni innovative e più intelligenti contro il cancro. La strada è ancora lunga, ma i risultati sono davvero promettenti e ci spingono a continuare la ricerca in questa direzione affascinante!
Fonte: Springer