NAMPT: Il Guardiano Segreto dell’Alba della Vita Embrionale
Ehi scienziati in erba e curiosi di biologia! Avete mai pensato a cosa serve per far partire la vita, proprio lì, nelle primissime fasi dopo la fecondazione? È un processo incredibilmente delicato e complesso, e ogni piccolo ingranaggio deve funzionare alla perfezione. Oggi voglio parlarvi di uno di questi ingranaggi, un enzima un po’ misterioso ma fondamentale: il NAMPT (Nicotinamide fosforibosiltransferasi, un nome un po’ complicato, lo so!).
Forse avete già sentito nominare il NAMPT in contesti legati all’invecchiamento, al metabolismo o persino alle malattie neurodegenerative. Questo perché è un attore chiave nella produzione di una molecola vitale chiamata NAD+, essenziale per dare energia alle cellule e per un sacco di altri processi. Ma cosa fa esattamente NAMPT quando un embrione sta appena iniziando a formarsi, passando da una singola cellula fecondata (zigote) a una piccola pallina di cellule (morula)? Ecco, questo era un punto interrogativo… almeno fino ad ora!
La nostra indagine: cosa succede se NAMPT non fa il suo lavoro?
Nel nostro studio, ci siamo tuffati proprio in questo mistero. Abbiamo voluto capire il ruolo di NAMPT nello sviluppo embrionale precoce del topo. Come? Beh, abbiamo usato un approccio diretto: abbiamo “disturbato” l’attività di questo enzima usando un inibitore specifico (una molecola chiamata FK866) e poi abbiamo osservato attentamente cosa succedeva agli embrioni. Abbiamo usato tecniche come l’immunofluorescenza (per “colorare” e vedere dove si trova NAMPT e altre molecole) e l’imaging di cellule vive (per spiare i processi in tempo reale).
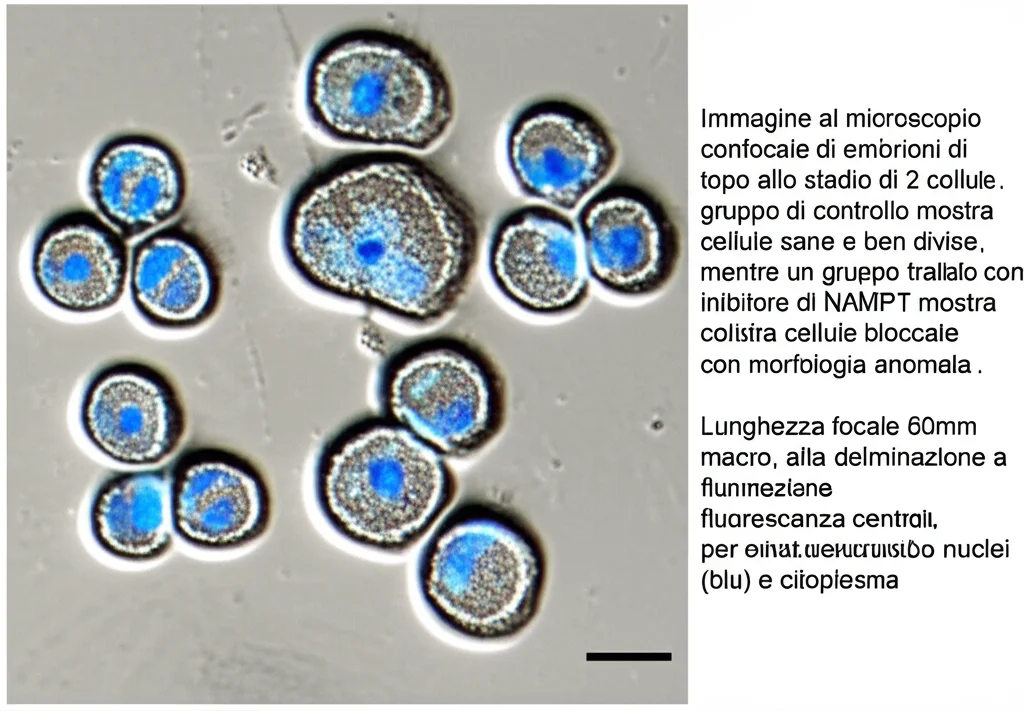
Prima di tutto, abbiamo controllato dove si trova e quanto è presente NAMPT negli embrioni. Abbiamo scoperto che il suo livello (come mRNA, l’istruzione per produrlo) rimane abbastanza stabile nelle prime fasi (zigote, 2 cellule, 4 cellule, 8 cellule). Interessante, però, è la sua posizione: nello zigote è attorno al nucleo, ma già a partire dallo stadio a 2 cellule, si sposta dentro il nucleo dei blastomeri (le cellule dell’embrione). Questo suggerisce che potrebbe avere un ruolo importante proprio quando si attiva il genoma dell’embrione stesso!
Bloccare NAMPT: uno stop allo sviluppo
E qui arriva il bello (o il brutto, per gli embrioni!). Quando abbiamo inibito NAMPT con FK866, abbiamo visto che lo sviluppo embrionale andava in tilt, e l’effetto dipendeva dalla dose dell’inibitore.
- Con una dose più alta (50 µM), già la prima divisione cellulare, quella che porta dallo zigote allo stadio a 2 cellule, falliva in molti casi. Meno della metà degli embrioni riusciva a completare questo primo passo fondamentale!
- Anche con una dose più bassa (30 µM), che permetteva la formazione delle 2 cellule, lo sviluppo successivo era gravemente compromesso. Pochissimi embrioni riuscivano a raggiungere lo stadio a 4 cellule e praticamente nessuno arrivava allo stadio di morula (una pallina compatta di cellule che si forma dopo circa 72 ore).
Questi risultati ci dicono una cosa forte e chiara: NAMPT è assolutamente essenziale per le prime divisioni cellulari e per il corretto sviluppo dell’embrione. Senza di lui, il processo si inceppa quasi subito.
Il collegamento con i mitocondri: le centrali energetiche in crisi
Ma perché NAMPT è così cruciale? Qual è il meccanismo? Dato il suo ruolo nel metabolismo energetico (tramite NAD+), abbiamo subito pensato ai mitocondri, le famose “centrali energetiche” delle cellule. Producono l’energia (ATP) necessaria per tutti i processi cellulari, incluse le rapide divisioni dell’embrione.
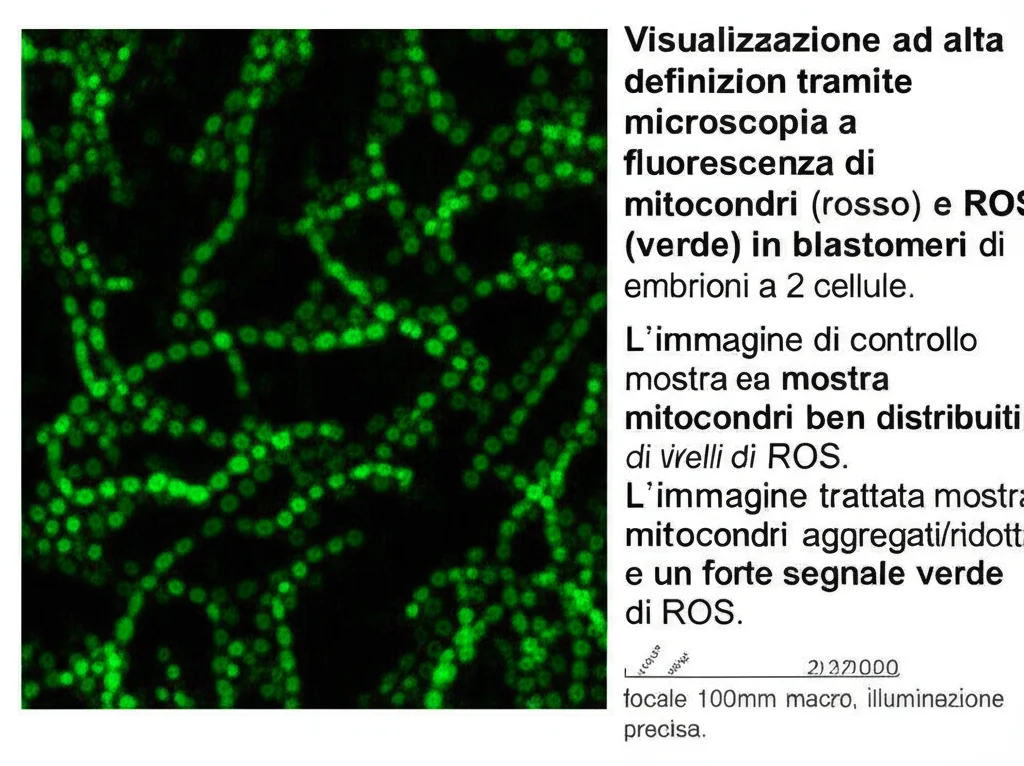
E avevamo ragione! Quando abbiamo inibito NAMPT negli embrioni a 2 cellule, abbiamo osservato un vero disastro a livello mitocondriale:
- Distribuzione anomala: Invece di essere distribuiti uniformemente nel citoplasma, i mitocondri si accumulavano in modo strano o la loro presenza (segnale fluorescente) diminuiva drasticamente in molte cellule.
- Numero ridotto: Abbiamo contato il DNA mitocondriale (mtDNA) e confermato che il numero totale di mitocondri era significativamente più basso negli embrioni trattati.
- Funzione compromessa: Abbiamo misurato il potenziale di membrana mitocondriale (MMP), un indicatore della loro “salute” e capacità di produrre energia. Risultato? Un crollo del potenziale, segno di una grave disfunzione.
- Squilibrio NAD+/NADH: Coerentemente con l’inibizione di NAMPT, abbiamo visto diminuire il rapporto NAD+/NADH, fondamentale per le reazioni redox e la produzione di energia.
In pratica, senza NAMPT, le centrali energetiche dell’embrione vanno in tilt, non riescono a lavorare bene e sono pure meno numerose. Questo è un problema enorme per cellule che hanno bisogno di tantissima energia per dividersi e svilupparsi.
Stress ossidativo: quando le cellule “arrugginiscono”
Un effetto collaterale molto pericoloso del malfunzionamento mitocondriale è l’aumento dello stress ossidativo. Quando i mitocondri non funzionano bene, possono produrre un eccesso di specie reattive dell’ossigeno (ROS), molecole instabili che possono danneggiare DNA, proteine e lipidi – un po’ come la ruggine per il metallo.
Abbiamo misurato i livelli di ROS negli embrioni trattati e, come sospettavamo, erano significativamente più alti rispetto ai controlli. Oltre l’80% degli embrioni trattati mostrava segnali evidenti di ROS, contro meno del 30% nei controlli. Questo ci dice che l’inibizione di NAMPT non solo toglie energia, ma scatena anche uno stato di stress ossidativo dannoso per le cellule embrionali.
Apoptosi: il programma di autodistruzione si attiva
Cosa succede quando una cellula è gravemente danneggiata e sotto stress? Spesso attiva un programma di “suicidio controllato” chiamato apoptosi. È un modo per eliminare cellule difettose o pericolose per l’organismo.
Abbiamo cercato i segni dell’apoptosi precoce usando un marcatore chiamato Annexin-V. Negli embrioni di controllo, i segnali erano quasi assenti. Ma negli embrioni trattati con l’inibitore di NAMPT, abbiamo visto chiaramente segnali positivi di Annexin-V, specialmente nelle zone di contatto tra le cellule. Circa il 60% degli embrioni trattati mostrava segni di apoptosi, contro il 33% dei controlli.
Abbiamo anche analizzato l’espressione di alcuni geni legati all’apoptosi e abbiamo trovato cambiamenti significativi: alcuni geni pro-apoptotici (come Bax e Jun) erano aumentati, mentre geni anti-apoptotici (come Bcl-2) o legati a specifiche vie apoptotiche (Caspase 8) erano alterati. Tutto questo conferma che lo stress indotto dalla mancanza di NAMPT spinge le cellule embrionali verso l’autodistruzione.
Conclusioni: NAMPT, un protettore indispensabile
Mettendo insieme tutti i pezzi, il nostro studio rivela un ruolo fondamentale e finora poco chiaro di NAMPT nello sviluppo embrionale precoce. Non è solo un enzima metabolico generico, ma un vero e proprio guardiano della salute mitocondriale e della sopravvivenza cellulare nelle primissime fasi della vita.
Possiamo riassumere così:
- NAMPT è presente e attivo negli embrioni precoci, localizzandosi nel nucleo a partire dallo stadio a 2 cellule.
- La sua attività è essenziale per le prime divisioni cellulari (clivaggio).
- NAMPT protegge la funzione mitocondriale, assicurando un numero adeguato di mitocondri, la loro corretta distribuzione e il mantenimento del potenziale di membrana.
- Regolando i mitocondri, NAMPT previene un eccessivo accumulo di ROS e quindi lo stress ossidativo.
- Prevenendo lo stress ossidativo, NAMPT protegge le cellule embrionali dall’attivazione dell’apoptosi.
Insomma, NAMPT si assicura che le fondamenta della vita siano solide, garantendo che le cellule abbiano l’energia necessaria e siano protette dai danni interni proprio nel momento più delicato. Una scoperta affascinante che ci aiuta a capire meglio la complessità e la bellezza dei primissimi istanti dello sviluppo!
Fonte: Springer