Telociti Epatici: Quando una Mutazione Genetica Blocca il Loro Potenziale Nascosto
Ciao a tutti! Oggi voglio parlarvi di qualcosa di veramente affascinante che sta emergendo nel campo della biologia cellulare, qualcosa che ci tocca da vicino perché riguarda il nostro fegato e come funziona, o a volte, come *non* funziona a causa di piccole “imperfezioni” nel nostro codice genetico. Parliamo dei telociti (TCs) epatici e di come una specifica mutazione genetica, quella del gene Npc1, possa mettere i bastoni tra le ruote al loro incredibile potenziale.
Chi sono questi Telociti?
Forse non ne avete mai sentito parlare, ma i telociti sono cellule davvero particolari. Immaginate delle cellule con un corpo piccolo piccolo e delle “braccia” incredibilmente lunghe e sottili, chiamate telopodi (Tps), che si estendono come fili nel tessuto circostante. Questi telopodi possono formare reti tridimensionali complesse, quasi come un’impalcatura vivente all’interno dei nostri organi, incluso il fegato. Si pensa che giochino un ruolo cruciale nel mantenere l’equilibrio dei tessuti (omeostasi) e forse anche nella loro riparazione e rigenerazione. Non hanno un singolo marcatore che gridi “Sono un telocita!”, ma li riconosciamo perché esprimono contemporaneamente diverse proteine sulla loro superficie, come CD34, c-Kit, Vimentina e PDGFR-α. È un po’ come riconoscere qualcuno non da un solo tratto, ma dall’insieme delle sue caratteristiche. Nel fegato, sembra che questi telociti siano distribuiti un po’ ovunque e recenti studi suggeriscono che possano “parlare” con le cellule staminali epatiche, aiutandole a fare il loro lavoro. Insomma, non sono semplici cellule di supporto passivo, ma veri e propri attori nella vita del nostro fegato!
Il Guastafeste: La Mutazione del Gene Npc1
Ora, introduciamo il “cattivo” della nostra storia: la mutazione del gene Npc1. Questa mutazione è la causa principale (nel 95% dei casi) di una malattia genetica rara ma devastante chiamata Malattia di Niemann-Pick di tipo C (NPC). È una malattia progressiva che colpisce soprattutto bambini e giovani, portando all’accumulo di lipidi (grassi, in particolare colesterolo non esterificato e sfingomielina) all’interno delle cellule, specialmente nei lisosomi, che sono un po’ i centri di riciclaggio della cellula. Quando il gene Npc1 è difettoso, la proteina NPC1 che ne deriva non funziona correttamente nel suo ruolo di “trasportatore” di lipidi. Questi lipidi si accumulano, intasando la cellula e compromettendone le funzioni. Purtroppo, ad oggi non esiste una cura efficace per la NPC, e la prognosi non è buona. Essendo una mutazione genetica, colpisce tutte le cellule del corpo, incluse, ovviamente, quelle del fegato.
Cosa Succede ai Telociti Epatici quando Npc1 Muta?
Ed eccoci al cuore della questione che abbiamo voluto indagare. Se i telociti sono importanti per il fegato e la mutazione Npc1 colpisce tutte le cellule, cosa succede ai telociti epatici in un organismo con questa mutazione? Per scoprirlo, abbiamo lavorato con modelli murini (topolini!), alcuni normali (Npc1+/+) e altri con la mutazione che causa la malattia (Npc1−/−). Abbiamo isolato i telociti dai fegati di topolini neonati di entrambi i gruppi, utilizzando una tecnica di digestione enzimatica migliorata e purificandoli. Poi li abbiamo coltivati in laboratorio.

Osservazioni Morfologiche: Sembrano Uguali, Ma…
La prima cosa che abbiamo fatto è stata osservare attentamente queste cellule al microscopio, sia quello ottico invertito che quello elettronico a scansione (SEM), che ci permette di vedere dettagli incredibili della loro superficie. Abbiamo anche usato tecniche di immunofluorescenza per “colorare” i marcatori specifici (Vimentina, CD34, c-Kit, PDGFR-α) e confermare che fossero proprio telociti. Sorprendentemente, sia i telociti dei topolini normali che quelli dei topolini mutanti apparivano molto simili! Avevano la stessa forma caratteristica – fusiforme, stellata, a seconda di quanti telopodi avessero – con un corpo cellulare piccolo e questi lunghi prolungamenti sottili, a volte con dei rigonfiamenti che li facevano assomigliare a collane di perle. Anche i marcatori di superficie erano presenti in entrambi i gruppi. Quindi, a prima vista, la mutazione Npc1 non sembrava alterare drasticamente la loro struttura.
La Vera Sorpresa: Il Potenziale di Differenziazione Bloccato
Ma l’aspetto non è tutto. I telociti, come altre cellule interstiziali simili alle staminali, potrebbero avere la capacità di differenziarsi, cioè di trasformarsi in altri tipi di cellule specializzate quando necessario. Questa è una caratteristica chiave per la rigenerazione dei tessuti. E qui è arrivata la vera sorpresa. Abbiamo provato a “spingere” i nostri telociti coltivati a diventare tre tipi diversi di cellule:
- Adipociti (cellule del grasso)
- Osteoblasti (cellule che costruiscono l’osso)
- Cardiomioblasti (precursori delle cellule muscolari cardiache)
Abbiamo usato dei “cocktail” specifici di sostanze chimiche per indurre queste trasformazioni. Ebbene, i risultati sono stati netti. I telociti dei topolini normali (Npc1+/+) hanno mostrato di possedere questo potenziale multilineare: una buona parte di loro riusciva a trasformarsi, accumulando goccioline di grasso (visibili con la colorazione Oil Red O), formando noduli calcificati (visibili con la colorazione Alizarin Red) o esprimendo proteine tipiche del muscolo cardiaco come la troponina T cardiaca (cTnT, visibile con immunofluorescenza).
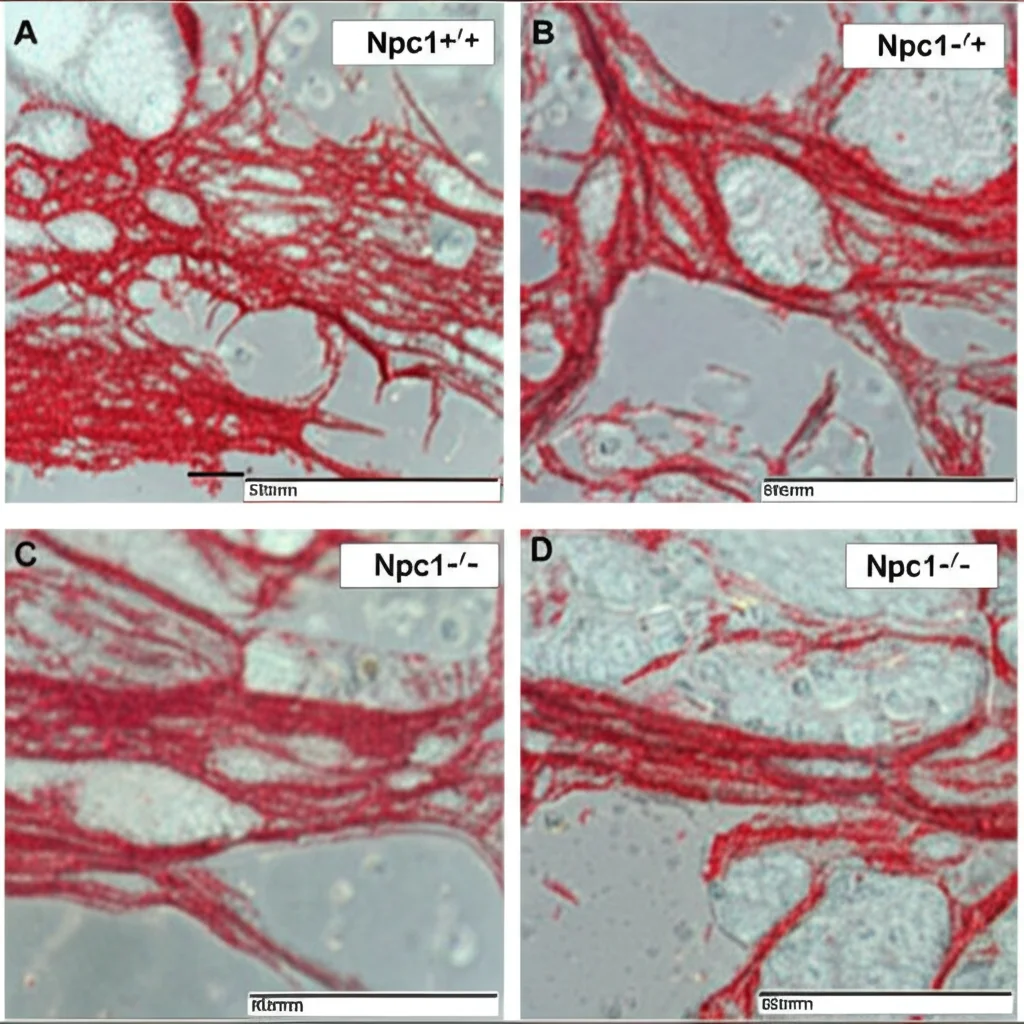
Ma i telociti dei topolini mutanti (Npc1−/−)? Un disastro. La loro capacità di differenziarsi in tutti e tre i tipi cellulari era significativamente ridotta. Molti meno telociti mutanti riuscivano a diventare adipociti, osteoblasti o cardiomioblasti rispetto ai loro corrispettivi sani. La colorazione era debole o assente. Era come se la mutazione Npc1 avesse bloccato questa loro incredibile versatilità.
Perché Succede Questo? L’Ipotesi del Traffico Lipidico
Questo ci porta a formulare un’ipotesi intrigante. Sappiamo che la proteina NPC1 è fondamentale per il trasporto dei lipidi all’interno della cellula. Sembra che questo corretto traffico lipidico non sia solo importante per evitare l’accumulo tossico visto nella malattia di Niemann-Pick, ma sia anche essenziale per mantenere la pluripotenza (la capacità di differenziarsi in più tipi cellulari) dei telociti. Quando NPC1 non funziona, l’accumulo di lipidi nei lisosomi potrebbe interferire con le complesse vie di segnalazione cellulare che governano la differenziazione. Studi recenti, infatti, suggeriscono che la carenza di NPC1 possa disturbare programmi trascrizionali (come quelli mediati da SREBP2) o vie di segnalazione (come PPARγ o Wnt/β-catenin) che sono cruciali per l’impegno verso specifici lignaggi cellulari, come quello mesenchimale (da cui derivano grasso, osso, muscolo). È affascinante pensare che la gestione dei grassi dentro una cellula sia così intimamente legata alla sua capacità di decidere “cosa fare da grande”!
Cosa Significa Tutto Questo?
Questa scoperta è importante per diverse ragioni.
- Ci offre una nuova prospettiva sulla patologia della NPC. Il deterioramento multisistemico visto in questa malattia potrebbe non essere dovuto solo all’accumulo tossico di lipidi, ma anche a un deficit nella capacità rigenerativa dei tessuti, mediato proprio dal malfunzionamento dei telociti (e forse di altre cellule simili).
- Suggerisce che i telociti potrebbero essere un bersaglio per future strategie terapeutiche, non solo per la NPC ma potenzialmente anche per altre malattie epatiche o condizioni che richiedono rigenerazione tissutale. Se capiamo come ripristinare la loro funzione, potremmo avere nuove armi a disposizione.
- Mette in luce un legame fondamentale e forse sottovalutato tra il metabolismo lipidico e la biologia delle cellule staminali/progenitrici.
In sintesi, il nostro lavoro ha dimostrato per la prima volta che la mutazione del gene Npc1, pur non alterando drasticamente l’aspetto dei telociti epatici, ne compromette severamente la capacità di differenziarsi in altri tipi cellulari. Questo apre nuove strade per capire meglio la malattia di Niemann-Pick C e il ruolo fondamentale che queste cellule affascinanti, i telociti, giocano nella salute e nella malattia del nostro fegato. C’è ancora tanto da scoprire, ma ogni passo avanti ci avvicina a comprendere i meccanismi complessi che governano la vita a livello cellulare.
Fonte: Springer