Vaiolo delle Scimmie: L’Infezione Naturale Arma le Cellule T con una Marcia in Più Rispetto al Vaccino?
Ciao a tutti, appassionati di scienza e curiosi del nostro incredibile sistema immunitario! Oggi voglio portarvi nel cuore di una ricerca che, lasciatemelo dire, mi ha davvero entusiasmato e che tocca un tema caldissimo: il vaiolo delle scimmie, o MPXV, e come il nostro corpo impara a difendersi.
Ricorderete tutti il trambusto del 2022, quando l’Organizzazione Mondiale della Sanità ha dichiarato l’epidemia di MPXV un’emergenza sanitaria globale. Anche se la situazione è migliorata, il virus continua a circolare e, anzi, recentemente ci sono state segnalazioni di un aumento dei casi in diverse regioni, inclusa una preoccupante epidemia di Clade I (quello più cattivello, con una letalità maggiore) nella Repubblica Democratica del Congo. Questo ci ricorda che non possiamo abbassare la guardia, soprattutto considerando che la vaccinazione contro il vaiolo, che offriva una certa protezione crociata, è stata interrotta negli anni ’70 nella maggior parte dei paesi. Di conseguenza, una grossa fetta della popolazione oggi è vulnerabile.
La Memoria delle Nostre Cellule T: Un Esercito da Studiare
Nonostante l’MPXV sia noto da oltre 50 anni, la risposta immunitaria umana, in particolare quella mediata dalle cellule T, non era stata ancora sviscerata completamente. Le cellule T sono un po’ come i soldati scelti del nostro sistema immunitario: riconoscono e distruggono le cellule infettate e aiutano a orchestrare tutta la risposta difensiva. Capire come si comportano dopo un’infezione da MPXV o dopo la vaccinazione è fondamentale.
Ed è qui che entra in gioco il nostro studio. Ci siamo chiesti: cosa succede alle cellule T memoria dopo un’infezione da MPXV? E come si confronta questa risposta con quella indotta dal vaccino MVA-BN (un vaccino di terza generazione contro il vaiolo, autorizzato anche per l’MPXV)?
Per scoprirlo, abbiamo arruolato un gruppo di persone guarite dall’infezione da MPXV e un altro gruppo di individui vaccinati con MVA-BN. Poi, abbiamo messo alla prova le loro cellule T usando cellule infettate con il virus Vaccinia (VACV), un parente stretto dell’MPXV (condividono circa l’84% del loro DNA virale!), il che ci permette di valutare la risposta in modo molto simile a come avverrebbe in un’infezione naturale.
Infezione vs. Vaccino: Chi Addestra Meglio i “Soldati”?
I risultati sono stati, a dir poco, illuminanti! Abbiamo osservato risposte robuste sia delle cellule T CD8+ (le “killer”) sia delle CD4+ (le “helper”) in entrambi i gruppi. Una cosa interessante è che la risposta delle cellule T sembra essere “orientata” principalmente verso le proteine virali espresse precocemente durante l’infezione. È come se il nostro sistema immunitario imparasse subito a riconoscere i primi segnali d’allarme del virus.
Abbiamo anche identificato sette specifici “bersagli” (epitopi, in gergo tecnico) sull’MPXV che vengono riconosciuti dalle cellule T CD8+ di persone con un particolare assetto genetico (HLA-A*02:01, molto comune nella popolazione). Ci siamo concentrati su uno di questi, l’epitopo G5R18-26, per analisi ancora più dettagliate, incluso il sequenziamento dell’RNA a livello di singola cellula (scRNAseq). Una tecnica pazzesca che ci permette di spiare cosa fa ogni singola cellula!
E qui arriva il bello: sebbene le cellule T specifiche per l’MPXV (quelle che riconoscono il virus, identificate con dei “marcatori” chiamati tetrameri) mostrassero fenotipi di differenziazione e attivazione simili tra convalescenti e vaccinati, quelle degli individui guariti dall’infezione naturale avevano una marcia in più. Mostravano una maggiore citotossicità (cioè, erano più brave a uccidere le cellule infette), un maggiore potenziale migratorio verso il sito dell’infezione (specialmente la pelle, dove l’MPXV fa più danni) e una maggiore espansione clonale dei loro recettori (TCR), il che suggerisce una risposta più “specializzata” e potente.

In pratica, sembra che l’infezione naturale “addestri” le cellule T in modo più efficace, rendendole più agguerrite e capaci di raggiungere rapidamente il campo di battaglia. Questo potrebbe avere implicazioni importanti per la protezione a lungo termine contro future infezioni.
Approfondimenti dal Laboratorio: Come Abbiamo “Interrogato” le Cellule T
Per arrivare a queste conclusioni, abbiamo usato diverse tecniche. L’ELISpot IFNγ ci ha permesso di contare quante cellule T producevano interferone gamma (una molecola segnale chiave) quando stimolate con il VACV. I convalescenti ne avevano significativamente di più rispetto ai controlli sani. Poi, con un saggio chiamato AIM (Activation-Induced Markers), abbiamo quantificato le cellule T CD8+ e CD4+ reattive al VACV, osservando che la loro “forza” era simile, anche se con una leggera predominanza delle CD4+ in media.
Abbiamo anche testato la risposta a dei “mega pool” di peptidi, cioè frammenti di proteine dell’MPXV. Qui, la risposta CD8+ alle proteine precoci era più forte, confermando quanto visto con il VACV. Curiosamente, la risposta CD4+ a questi peptidi era minima, il che potrebbe dipendere dalla copertura degli epitopi nel nostro pool. Questo sottolinea l’importanza di usare cellule infette intere per avere un quadro più completo, perché così si valutano gli antigeni processati naturalmente.
Quando abbiamo confrontato i convalescenti con i vaccinati, abbiamo visto che entrambi i gruppi montavano una risposta significativa. Tuttavia, i convalescenti tendevano ad avere una risposta leggermente più forte. Analizzando l’epitopo dominante ILD (quello che vi dicevo prima, G5R18-26) con i tetrameri, abbiamo visto che la frequenza di cellule T CD8+ specifiche era significativamente più alta nei convalescenti. Queste cellule, in entrambi i gruppi, erano prevalentemente di tipo “effettore memoria” (TEMRA: CD45RA+CCR7-), ma con alcune differenze sottili. Ad esempio, nei convalescenti c’era una minore espressione di KLRG1, un marcatore che, quando si riduce, può indicare cellule con maggiore potenziale di proliferazione e citotossicità a lungo termine.
Cosa ci Dice l’RNA delle Singole Cellule?
L’analisi scRNAseq sulle cellule T specifiche per l’epitopo ILD è stata la ciliegina sulla torta. Abbiamo identificato diversi cluster di cellule con firme geniche distinte. Un cluster era particolarmente “citotossico” (esprimeva geni come GZMB e NKG7), un altro più “attivato” (con geni come FOS e CD69). Indovinate un po’? Le cellule dei convalescenti erano più abbondanti nel cluster attivato e mostravano un’espressione significativamente maggiore di geni legati all’attivazione (come FOS, CD69) e alla citotossicità (come GNLY, GZMA) rispetto ai vaccinati.
Anche il repertorio dei recettori delle cellule T (TCR) era diverso. Nei convalescenti, i TCR erano più espansi clonalmente (cioè, c’erano più copie dello stesso “soldato specializzato”) e mostravano un uso preferenziale di certi geni per costruire il recettore. Questo suggerisce una risposta più mirata e forse più efficiente, forgiata dalla “battaglia” reale contro il virus.
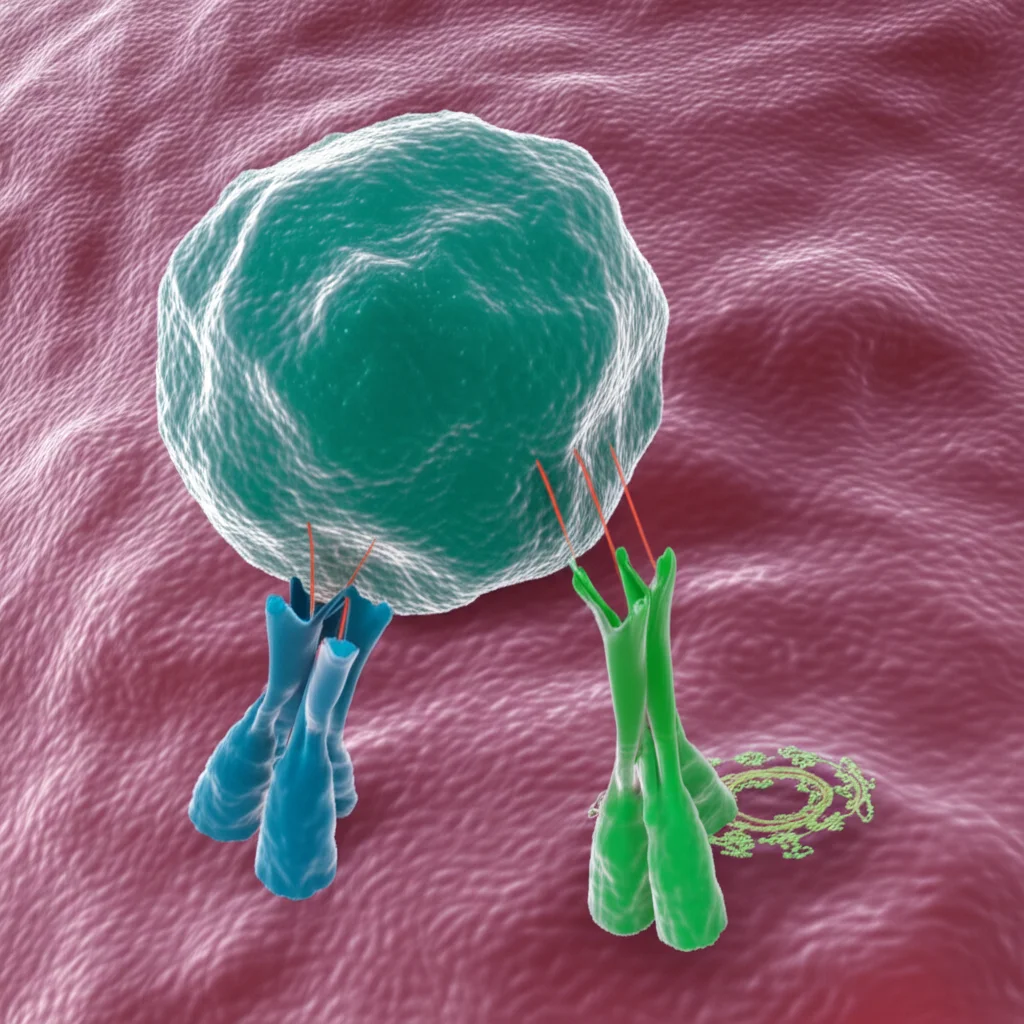
Cellule T “Giramondo”: Pronte a Raggiungere la Pelle
Un altro aspetto affascinante emerso dall’analisi scRNAseq, e confermato poi con la citometria a flusso, è il potenziale migratorio. Le cellule T dei convalescenti esprimevano livelli più alti di diverse molecole (integrine come ITGA4/CD49d, ITGB1/CD29; e molecole come CD44, GPR183) che sono cruciali per permettere alle cellule T di “viaggiare” e raggiungere specifici tessuti, in particolare la pelle. GPR183, per esempio, è un recettore che aiuta le cellule T a migrare verso le aree infiammate della pelle in risposta a segnali chimici (ossisteroli) rilasciati durante l’infezione.
Questo è super importante perché l’MPXV causa lesioni cutanee, quindi avere cellule T “programmate” per andare lì velocemente è un vantaggio enorme. Confrontando queste cellule T con quelle specifiche per SARS-CoV-2, abbiamo visto che quelle anti-MPXV dei convalescenti erano particolarmente “attrezzate” per la migrazione cutanea e mostravano profili di attivazione e citotossicità superiori.
Implicazioni per il Futuro: Verso Vaccini Migliori?
Cosa significa tutto questo? Beh, i nostri dati suggeriscono che l’infezione naturale da MPXV potrebbe indurre una memoria delle cellule T con una funzionalità effettrice e un potenziale migratorio verso la pelle superiori rispetto alla vaccinazione con MVA-BN (almeno per come viene somministrato attualmente). Questo non vuol dire che il vaccino non sia utile, anzi! Induce comunque una risposta robusta. Però, c’è forse margine per migliorare.
Potremmo pensare a strategie vaccinali che mimino più da vicino l’infezione naturale per generare cellule T memoria con queste caratteristiche “potenziate”. Ad esempio, la via di somministrazione del vaccino potrebbe fare la differenza: una vaccinazione intradermica potrebbe “addestrare” meglio le cellule T direttamente nella pelle, inducendo magari una memoria tissutale residente (Trm) più efficace.
Certo, il nostro studio ha delle limitazioni: il numero di partecipanti non è enorme e ci siamo concentrati molto su un singolo epitopo, seppur dominante. Serviranno studi più ampi per confermare e generalizzare questi risultati. Sarebbe anche fantastico poter analizzare le cellule T direttamente dalle lesioni cutanee, per capire ancora meglio cosa succede “sul campo”.
In conclusione, abbiamo fatto un bel passo avanti nel capire come il nostro sistema immunitario risponde all’MPXV. L’infezione sembra lasciare un’impronta più “combattiva” e “direzionata” sulle cellule T memoria. Queste scoperte non solo ci aiutano a comprendere meglio l’immunità agli orthopoxvirus, ma potrebbero anche spianare la strada a vaccini di nuova generazione, ancora più efficaci nel proteggerci.
È un campo di ricerca in continua evoluzione, e ogni pezzetto di conoscenza che aggiungiamo è prezioso. Spero di avervi trasmesso un po’ della passione che mettiamo nel nostro lavoro quotidiano per svelare i segreti del nostro corpo!
Fonte: Springer Nature