Accendi i Colori Nascosti: L’Elettrochimica Rivoluziona l’Imaging Cellulare
Avete mai provato a guardare dentro una cellula al microscopio? È un mondo affascinante, pieno di strutture intricate e processi dinamici. Noi ricercatori usiamo spesso la microscopia a fluorescenza per “accendere” specifiche parti della cellula con colori diversi, un po’ come usare evidenziatori molecolari. Questo ci permette di capire chi fa cosa e dove, all’interno di quel microcosmo brulicante di vita. Ma c’è un problema: distinguere tanti colori diversi contemporaneamente è un bel rompicapo. Immaginate di avere solo pochi evidenziatori che però hanno colori molto simili tra loro… diventa difficile capire quale struttura è evidenziata da quale colore! Ecco, fino ad oggi, questo era uno dei grandi limiti dell’imaging multicolore. Ma se vi dicessi che abbiamo trovato un modo nuovo e super ingegnoso per aggirare questo ostacolo, usando un trucco che ha a che fare con… l’elettricità?
Il Limite dei Colori Tradizionali
Normalmente, per vedere più cose insieme in una cellula, usiamo fluorofori (le nostre molecole-evidenziatore) che emettono luce a colori (lunghezze d’onda) ben distinti. Verde, rosso, blu… più sono diversi, meglio è. Il microscopio usa filtri speciali per separare questi colori e mostrarci immagini distinte. Il problema è che lo spettro dei colori visibili non è infinito, e spesso i fluorofori disponibili hanno colori che si sovrappongono un po’. Questo crea una sorta di “rumore di fondo” o cross-talk, dove il segnale di un colore “sporca” quello di un altro, rendendo difficile capire cosa stiamo guardando esattamente.
Certo, negli anni sono state sviluppate tecniche alternative: si possono usare fluorofori che emettono nell’infrarosso, oppure distinguere le molecole in base a quanto tempo impiegano a spegnersi dopo essere state illuminate (la loro “vita fluorescente”), o persino in base a quanto velocemente sbiadiscono sotto la luce del laser (il fotobleaching). Tecniche potenti, per carità, ma spesso richiedono strumenti ottici complessi, costosi e non sempre accessibili a tutti i laboratori. Insomma, serviva un’idea diversa, più semplice e versatile.
L’Idea Geniale: Modulazione Elettrochimica
Ed ecco la svolta! Recentemente, abbiamo scoperto (e altri gruppi di ricerca hanno confermato) che la luminosità di alcuni fluorofori organici e proteine fluorescenti può essere controllata applicando un potenziale elettrico esterno. In parole povere, possiamo “accendere” e “spegnere” o, meglio, modulare l’intensità della fluorescenza semplicemente variando una piccola tensione elettrica. La cosa davvero interessante è che fluorofori diversi reagiscono in modo diverso a queste variazioni di potenziale. Alcuni si accendono e spengono bruscamente a certi voltaggi, altri hanno una risposta più graduale, altri ancora mostrano picchi e valli di luminosità unici.
Abbiamo pensato: e se usassimo queste “impronte digitali” elettriche per distinguere i fluorofori, anche quelli che hanno colori quasi identici? Abbiamo chiamato questo profilo di risposta unico di ogni fluoroforo al variare del potenziale il suo “spettro elettrochimico” o spettro EC. L’idea è semplice ma potente: invece di basarci solo sul colore, aggiungiamo una nuova dimensione – la risposta elettrica – per separare i segnali.
Come Funziona Questa Magia?
Per mettere in pratica questa idea, non abbiamo dovuto stravolgere i microscopi esistenti. La chiave è usare un vetrino coprioggetto speciale, rivestito con uno strato sottilissimo e trasparente di ossido di indio-stagno (ITO). L’ITO è un conduttore elettrico, quindi il vetrino stesso diventa un elettrodo! Colleghiamo questo vetrino a un dispositivo chiamato potenziostato (insieme ad altri due elettrodi, uno di riferimento e uno ausiliario, come in un classico setup elettrochimico) che ci permette di controllare con precisione il potenziale sulla superficie del vetrino dove sono adagiate le cellule.
Ora, c’è un piccolo dettaglio: applicare un potenziale direttamente sul vetrino funziona bene per le molecole vicinissime alla superficie, ma come facciamo a modulare i fluorofori dentro l’intera cellula? Abbiamo risolto introducendo nel buffer (il liquido in cui teniamo le cellule) una coppia di molecole redox (cisteamina e ferricianuro) in condizioni di basso ossigeno. Queste molecole agiscono come “messaggeri” chimici, trasportando l’effetto del potenziale elettrico a tutti i fluorofori all’interno della cellula, anche quelli più lontani dall’elettrodo ITO. Per ora, questa tecnica funziona al meglio su cellule fissate e permeabilizzate (cioè non vive, ma con la membrana resa porosa), il che è comunque perfetto per molti studi che usano anticorpi marcati con fluorofori (immunofluorescenza).

Abbiamo provato con due fluorofori rossi molto usati, ATTO 655 e STAR RED, che hanno spettri di emissione simili. Marcando i microtubuli (una parte dello scheletro cellulare) con questi due coloranti in cellule separate e applicando un potenziale variabile, abbiamo visto chiaramente le differenze: ATTO 655 mostrava una risposta quasi “ON-OFF”, accendendosi e spegnendosi nettamente, mentre STAR RED aveva una variazione di luminosità più dolce e graduale nello stesso intervallo di potenziale. Bingo! Ogni fluoroforo ha il suo “ritmo” elettrico.
Dalla Teoria alla Pratica: Risultati Sorprendenti
A questo punto, ci siamo chiesti: possiamo usare queste differenze per separare i segnali quando i fluorofori sono mescolati nella stessa cellula? La risposta è sì, usando un algoritmo matematico chiamato unmixing lineare (separazione lineare). È un concetto simile a quello usato per separare colori spettralmente sovrapposti, ma qui lo applichiamo agli spettri EC. In pratica, misuriamo la fluorescenza totale di ogni pixel dell’immagine mentre varia il potenziale elettrico. Conoscendo gli spettri EC “puri” di ogni fluoroforo (ottenuti da campioni di riferimento o da zone dell’immagine dove c’è un solo tipo di fluoroforo), l’algoritmo calcola quanta parte del segnale totale in quel pixel proviene da ciascun fluoroforo.
Abbiamo fatto una prova “spaziale” simulata: abbiamo creato un’immagine digitale con zone contenenti solo ATTO 655, zone con solo STAR RED e zone miste, aggiungendo anche del rumore per simulare le condizioni reali. L’algoritmo di unmixing ha ricostruito perfettamente le distribuzioni originali dei due fluorofori, dimostrando la sua robustezza.
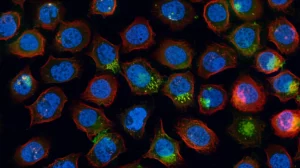
Poi siamo passati all’esperimento vero su un microscopio confocale standard. Abbiamo preso cellule HeLa (una linea cellulare molto usata) e abbiamo marcato ben sei strutture diverse usando coppie di fluorofori con colori simili in tre canali spettrali (verde, rosso, rosso lontano):
- Verde: Microtubuli (EGFP, geneticamente) e Vimentina (Alexa 488, anticorpo)
- Rosso: Nucleo (mCherry, geneticamente) e Recettore della Transferrina (Alexa 568, anticorpo)
- Rosso Lontano: Actina (ATTO 655, falloidina) e Paxillina (STAR 635, anticorpo)
Guardando le immagini “grezze” acquisite durante la scansione del potenziale, era un gran miscuglio di segnali. Ma applicando l’unmixing basato sugli spettri EC distinti di ogni coppia (ad esempio, Alexa 488 rispondeva molto di più al potenziale rispetto a EGFP), siamo riusciti a separare nettamente tutte e sei le strutture! L’immagine finale combinata mostrava ogni componente cellulare con il suo “colore” virtuale, senza quasi nessuna sovrapposizione spuria (il cosiddetto cross-talk, che abbiamo misurato essere bassissimo).
Spingersi Oltre: Quattro Colori in Uno e Super-Risoluzione STED
Ma perché fermarsi a coppie? Abbiamo alzato la posta: siamo riusciti a distinguere quattro diversi fluorofori (Alexa 568, mCherry, Alexa 555, Alexa 594) che emettono tutti nella stessa regione rossa dello spettro, usati per marcare rispettivamente recettore della transferrina, nucleo, actina e mitocondri. Anche qui, le loro diverse “danze” elettriche (spettri EC) ci hanno permesso di separarli con l’unmixing, ottenendo immagini chiare di tutte e quattro le strutture usando un solo canale di rilevamento del microscopio! Roba da non credere fino a poco tempo fa.
E non è finita. Abbiamo applicato la stessa strategia alla microscopia a super-risoluzione STED. La STED permette di vedere dettagli molto più fini del limite di diffrazione della luce, ma fare STED multicolore è tradizionalmente complesso: richiede laser multipli, allineamenti perfetti e spesso compromessi sulla qualità dell’immagine o sull’efficienza. Noi abbiamo dimostrato che è possibile fare STED a quattro colori (usando i coloranti STAR RED, STAR 635, SiR e ATTO 655 per marcare microtubuli, paxillina, DNA e actina) usando un setup STED per un singolo colore! Acquisiamo semplicemente immagini STED a diversi potenziali elettrici fissi (scelti per massimizzare le differenze negli spettri EC) e poi applichiamo il nostro algoritmo di unmixing. Il risultato? Immagini a super-risoluzione di quattro strutture diverse, ottenute con un setup ottico enormemente semplificato.

Perché Questa Tecnica Cambia le Regole del Gioco
Questa tecnica basata sulla modulazione elettrochimica della fluorescenza è, secondo me, una piccola rivoluzione. I vantaggi sono evidenti:
- Espande le capacità multicolore: Permette di distinguere molti più fluorofori, anche quelli spettralmente simili, su un singolo canale.
- Nessuna modifica hardware: Funziona su microscopi a fluorescenza standard (confocali, widefield) e STED senza bisogno di aggiungere laser, filtri o detector complessi.
- Semplicità e accessibilità: Rende l’imaging multicolore avanzato e persino la STED multicolore molto più semplici ed economici.
- Versatilità: Funziona con una vasta gamma di fluorofori comuni (rodamine, cianine, ossazine, proteine fluorescenti).
Certo, ci sono ancora aspetti da esplorare e ottimizzare, come la scelta dei fluorofori con spettri EC più diversi possibile (meglio scegliere famiglie chimiche diverse) e l’estensione a cellule vive (che per ora è una sfida). Ma il potenziale è enorme. Immaginate le scoperte che potremmo fare potendo osservare contemporaneamente quattro, cinque, sei o più processi cellulari interagire tra loro, con una chiarezza e una semplicità impensabili prima. L’elettrochimica, un campo apparentemente distante dalla microscopia ottica, ci ha regalato una nuova, potente lente per scrutare i segreti della vita cellulare. Non è affascinante?
Fonte: Springer