Epatite B: E se il Vaccino Non Fosse Perfetto? Sveliamo i Segreti con la Matematica “con Memoria”!
Ciao a tutti! Oggi voglio portarvi con me in un viaggio affascinante, un po’ diverso dal solito. Parleremo di una malattia seria, l’Epatite B, ma lo faremo usando uno strumento potentissimo e, per certi versi, magico: la matematica. Niente paura, non vi sommergerò di equazioni incomprensibili! Cercherò di raccontarvi come, grazie a nuovi approcci matematici, stiamo cercando di capire meglio come si diffonde questo virus e come possiamo combatterlo, anche quando le cose non sono “perfette” come vorremmo.
Cos’è l’Epatite B e Perché Modellarla?
Partiamo dalle basi. L’Epatite B è un’infezione del fegato causata dal virus HBV. Può essere una cosa passeggera (acuta) o diventare cronica, portando a problemi gravi come cirrosi o cancro al fegato. Si trasmette in vari modi: dalla mamma al bambino alla nascita, tra bambini piccoli, tramite sangue infetto (tatuaggi, piercing non sicuri) o fluidi corporei. È un problema di salute pubblica globale, specialmente in alcune aree come l’Africa Sub-Sahariana.
Ora, vi chiederete: cosa c’entra la matematica? Beh, fin dal 1760 (avete letto bene, secoli fa!), con Bernoulli che studiava l’efficacia della vaccinazione contro il vaiolo, la matematica è diventata un’alleata fondamentale per descrivere, prevedere e controllare le malattie infettive. Creiamo dei “modelli”, delle specie di simulazioni basate su equazioni, che ci aiutano a capire le dinamiche di diffusione. Pensateli come delle mappe concettuali super avanzate che ci mostrano come si muove un’infezione in una popolazione.
Il Limite dei Modelli Tradizionali: Il Vaccino “Perfetto”
Negli anni sono stati sviluppati molti modelli per l’HBV. Alcuni molto sofisticati, che dividono la popolazione in gruppi:
- Suscettibili (S): Chi può ancora infettarsi.
- Vaccinati (V): Chi ha ricevuto il vaccino.
- Latenti (L): Infetti ma non ancora infettivi.
- Infetti Acuti (Ia): Con sintomi.
- Portatori Asintomatici (Iac): Infetti, infettivi ma senza sintomi evidenti.
- Portatori Cronici (Ic): Infetti a lungo termine.
- Guariti/Rimossi (R): Chi ha superato l’infezione o è immune.
Questi modelli ci hanno insegnato tanto. Ma spesso, per semplificare le cose, si faceva un’ipotesi un po’ troppo ottimistica: che il vaccino fosse perfetto al 100%. Chi si vaccina, non si ammala. Punto. Bello, vero? Peccato che nella realtà non sia sempre così. L’efficacia di un vaccino dipende da tanti fattori, incluso il sistema immunitario di ciascuno. Assumere una protezione totale può portare a previsioni non del tutto accurate. Un altro punto debole era considerare la trasmissione come una semplice “azione di massa”, senza tener conto della densità della popolazione infetta.
La Nostra Svolta: Vaccini Imperfetti e Matematica “con Memoria”
Ed ecco dove entra in gioco il nostro studio. Abbiamo pensato: “E se provassimo a rendere il modello più realistico?”. Così, abbiamo introdotto due cambiamenti chiave:
1. Vaccino Imperfetto: Abbiamo considerato che una certa frazione di persone vaccinate possa comunque infettarsi (ovviamente con rischi molto minori rispetto ai non vaccinati, ma non nulli). Abbiamo chiamato ‘p’ l’efficacia del vaccino (se p=0.95, il vaccino protegge al 95%, ma c’è un 5% di possibilità residua).
2. Incidenza Standard: Abbiamo usato una formula per la forza dell’infezione ((lambda(t))) che tiene conto della proporzione di infetti nella popolazione totale, rendendola più aderente alla realtà quando la popolazione cambia.
3. Trattamento per i Portatori: Abbiamo incluso la possibilità che i portatori cronici ricevano un trattamento, potendo acquisire immunità definitiva o, in alternativa, ricevere il vaccino.
Ma la vera novità, quella che rende tutto più “intrigante”, è l’uso del calcolo frazionario, in particolare la derivata di Caputo. Fermi tutti, lo so cosa state pensando! “Frazionario? Derivata?”. Tranquilli. Immaginate che i modelli tradizionali (con derivate “intere”, quelle classiche) vedano il presente come influenzato solo dall’istante immediatamente precedente. Il calcolo frazionario, invece, introduce una sorta di “memoria” nel sistema. È come se il modello “ricordasse” non solo lo stato di ieri, ma anche quello dell’altro ieri, e così via, dando più peso al passato recente. Questo è super utile nelle epidemie, perché la diffusione attuale dipende spesso dalla storia passata dell’infezione nella popolazione. L’ordine della derivata frazionaria, che chiamiamo (alpha) (un numero tra 0 e 1), ci dice “quanta memoria” ha il sistema. Se (alpha=1), torniamo al modello classico senza memoria. Se (alpha) è minore di 1, la memoria entra in gioco.
Cosa Abbiamo Scoperto: Stabilità, Soglie e Sorprese
Analizzando sia il modello classico ((alpha=1)) sia quello frazionario ((0 < alpha < 1)), abbiamo fatto scoperte interessanti. Innanzitutto, abbiamo calcolato il famoso Numero di Riproduzione di Controllo ((mathcal{R}_c)). È un valore soglia cruciale. Se (mathcal{R}_c < 1), in teoria l'epidemia dovrebbe spegnersi da sola. Se (mathcal{R}_c > 1), l’infezione tende a diventare endemica, cioè a rimanere stabilmente presente nella popolazione. Abbiamo dimostrato che, sotto certe condizioni (come una buona copertura vaccinale e bassa trasmissibilità), il punto di equilibrio “senza malattia” è stabile: l’infezione viene eradicata.
Ma attenzione, c’è un colpo di scena! Abbiamo trovato la possibilità di un fenomeno chiamato biforcazione all’indietro (backward bifurcation). Cosa significa? Che a volte, anche se riusciamo a portare (mathcal{R}_c) appena sotto 1 (il valore magico!), l’infezione potrebbe non sparire del tutto. Potrebbe coesistere un equilibrio endemico stabile accanto a quello senza malattia. In pratica, per eliminare davvero l’HBV, non basta scendere sotto 1, ma bisogna andare *ben* al di sotto, superando un’altra soglia critica. Questo succede quando, ad esempio, l’efficacia del vaccino non è altissima o ci sono altri fattori che complicano le cose. È una scoperta importante perché ci dice che le strategie di controllo potrebbero dover essere più aggressive del previsto.
Abbiamo anche usato strumenti matematici avanzati (come il principio di contrazione di Banach e il criterio di Ulam-Hyers) per assicurarci che il nostro modello frazionario fosse “ben comportato”: che avesse soluzioni uniche e stabili, resistenti a piccole perturbazioni. Insomma, che fosse affidabile!

Il Test sul Campo: L’Epatite B in Nigeria
La teoria è bella, ma funziona nel mondo reale? Per scoprirlo, abbiamo preso i dati reali sui casi di Epatite B riportati in Nigeria tra il 2010 e il 2021. La Nigeria è un paese dove l’HBV è purtroppo endemica. Usando tecniche statistiche (minimi quadrati non lineari), abbiamo “calibrato” il nostro modello, cioè abbiamo stimato i valori dei parametri (tasso di trasmissione (beta), tassi di recupero, efficacia del vaccino ‘p’, ecc.) che meglio si adattavano ai dati reali.
Il risultato? Abbiamo stimato un (mathcal{R}_c approx 1.766). Essendo significativamente maggiore di 1, questo conferma matematicamente che l’Epatite B è endemica in Nigeria e la sua trasmissione è sostenuta. Le simulazioni del modello si adattavano bene ai dati storici. Poi abbiamo usato il modello per fare previsioni: purtroppo, i risultati suggeriscono che l’HBV rimarrà un problema sanitario rilevante nel paese nei prossimi anni se non si interviene in modo deciso.
Simulazioni al Computer: Vedere la Matematica in Azione
Per esplorare ulteriormente il modello, specialmente quello frazionario, abbiamo usato metodi numerici avanzati (come Adams-Bashforth) per simulare l’evoluzione dell’epidemia al computer. Abbiamo verificato che per (alpha=1), il metodo frazionario dava gli stessi risultati dei metodi classici (Runge-Kutta), confermando la coerenza.
Poi abbiamo giocato con (alpha). Abbiamo visto che cambiando il valore di (alpha) (cioè cambiando la “memoria” del sistema), le curve epidemiche cambiavano. Ad esempio, diminuendo (alpha), la densità di individui nello stadio latente e portatore tendeva a diminuire più lentamente, mostrando come la memoria del passato influenzi la dinamica attuale.
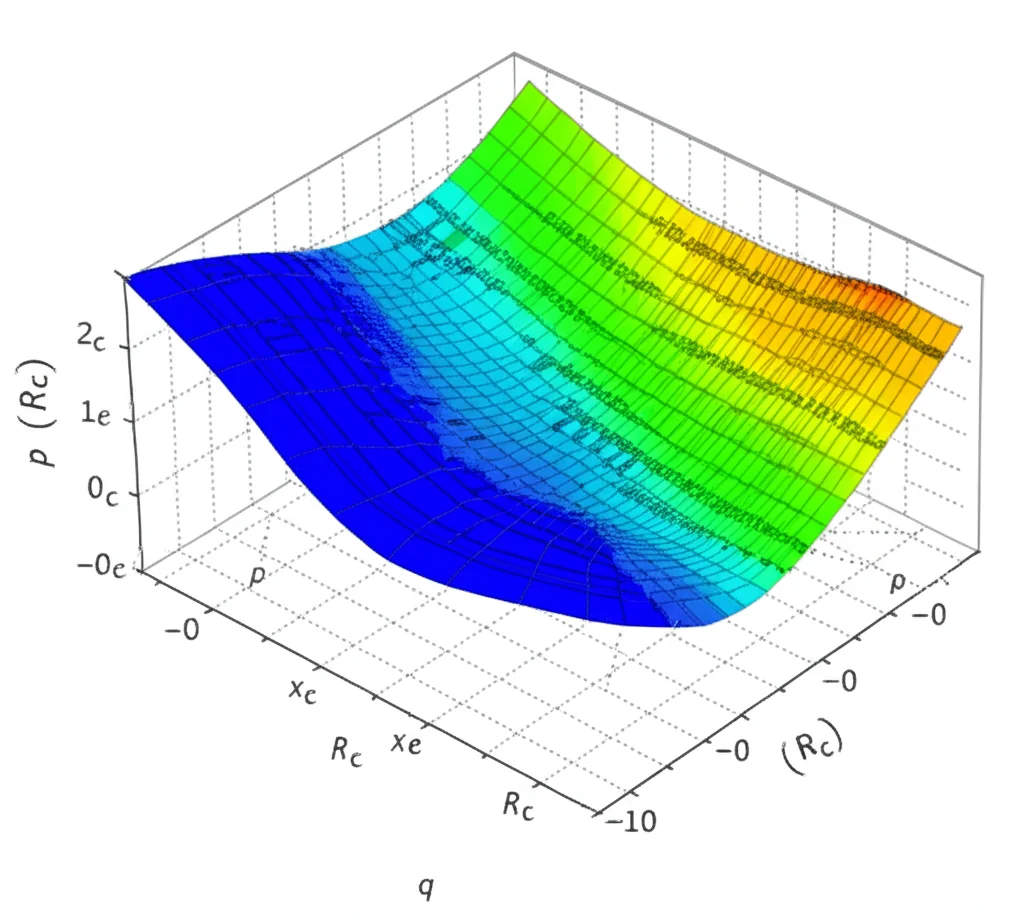
Abbiamo anche visualizzato la biforcazione all’indietro: impostando i parametri in modo che (mathcal{R}_c) fosse poco sotto 1 (es. 0.98), abbiamo visto che a seconda delle condizioni iniziali (quanti infetti c’erano all’inizio), le traiettorie potevano andare sia verso l’estinzione della malattia, sia verso uno stato endemico a basso livello. Un chiaro segnale che la soglia (mathcal{R}_c=1) non è sempre una garanzia di eliminazione.
Infine, abbiamo esplorato come (mathcal{R}_c) cambia al variare di parametri chiave:
- Aumentando il tasso di trasmissione ((beta)) o diminuendo l’immunità data dal vaccino ((omega)), (mathcal{R}_c) sale (logico!).
- Aumentando il tasso di vaccinazione (q) e l’efficacia del vaccino (p), (mathcal{R}_c) scende. Questo conferma l’importanza cruciale di campagne vaccinali ampie e con vaccini efficaci.
Cosa Portiamo a Casa?
Questo studio, usando la matematica frazionaria e considerando vaccini non perfetti, ci ha dato una visione più sfumata e realistica della trasmissione dell’Epatite B. Abbiamo visto che:
- Il calcolo frazionario, con la sua “memoria”, può catturare meglio le dinamiche complesse delle epidemie.
- L’efficacia imperfetta del vaccino è un fattore da non sottovalutare.
- Il fenomeno della biforcazione all’indietro ci avverte che eradicare l’HBV potrebbe richiedere sforzi maggiori di quanto suggerito dalla sola soglia (mathcal{R}_c=1).
- Nel caso della Nigeria, i dati e il modello confermano l’endemicità e la necessità di interventi robusti.
- Aumentare copertura ed efficacia vaccinale rimane una strategia chiave.
Certo, c’è ancora lavoro da fare. Prossimamente, vorremmo analizzare quali parametri influenzano di più la diffusione (analisi di sensibilità) e usare questi modelli per studiare le strategie di controllo ottimali, confrontando diverse combinazioni di interventi (vaccinazione, trattamento, prevenzione) per capire quale sia la più efficace ed efficiente.
Spero che questo tuffo nella matematica applicata alla salute vi sia piaciuto! È incredibile come numeri e formule possano aiutarci a comprendere e, speriamo, a sconfiggere malattie complesse come l’Epatite B.
Fonte: Springer