Meningioma in 3D: Creare un “Avatar” del Tumore in Laboratorio per Cure su Misura
Ciao a tutti! Oggi voglio parlarvi di qualcosa che mi appassiona profondamente: la lotta contro i tumori cerebrali, in particolare i meningiomi. Sembra un argomento complesso, e in parte lo è, ma cercherò di raccontarvelo in modo semplice e, spero, affascinante. Immaginate di poter creare una copia quasi perfetta del tumore di un paziente, ma in laboratorio. Non sarebbe fantastico per testare farmaci e trovare la cura più adatta proprio per *quella* persona? Ecco, è un po’ quello che stiamo cercando di fare.
La Sfida dei Meningiomi e i Limiti Attuali
I meningiomi sono i tumori primari più comuni del sistema nervoso centrale. Nascono dalle meningi, le membrane che avvolgono cervello e midollo spinale. La buona notizia è che la maggior parte sono benigni (WHO grado 1). La cattiva notizia è che alcuni possono essere più aggressivi (grado 2 o 3) e, soprattutto, la loro posizione può rendere la chirurgia, che è il trattamento principale, molto rischiosa o incompleta. Pensate a un tumore alla base del cranio: rimuoverlo tutto può essere un vero incubo per il chirurgo e per il paziente.
Ecco perché c’è un bisogno disperato di terapie farmacologiche efficaci. Il problema? Finora, nessuna pillola magica ha funzionato per tutti. I meningiomi sono biologicamente complessi e diversi da paziente a paziente. Quello che funziona per uno, potrebbe non funzionare per un altro. È qui che entra in gioco la medicina personalizzata: l’idea di abbandonare l’approccio “taglia unica” per abbracciare strategie su misura.
Ma come si fa a testare i farmaci in modo personalizzato? I modelli preclinici sono la chiave.
- Modelli animali (in vivo): Usare cellule tumorali del paziente impiantate negli animali è l’approccio che più si avvicina alla realtà biologica. Però, diciamocelo, è un processo lungo, costoso e poco pratico per testare tanti farmaci su larga scala per ogni singolo paziente.
- Colture cellulari 2D (in vitro): Le classiche piastre di Petri dove le cellule crescono piatte, in uno strato singolo. Sono economiche e veloci, ma terribilmente semplicistiche. Mancano le interazioni tridimensionali tra cellule e con l’ambiente circostante (la matrice extracellulare), fondamentali per il comportamento del tumore. Questo può portare a sovrastimare l’efficacia di un farmaco.
Insomma, avevamo bisogno di qualcosa a metà strada: un modello più realistico del 2D, ma meno costoso e complesso degli animali.
L’Idea: Un Modello 3D “Xeno-Free” dal Paziente
Ed eccoci al cuore della nostra ricerca: sviluppare un modello di coltura cellulare tridimensionale (3D) direttamente dalle cellule tumorali del paziente. L’obiettivo era creare delle mini-repliche del tumore, chiamate sferoidi o organoidi, che ne mimassero meglio la struttura e la fisiologia. E c’è un dettaglio importante: volevamo farlo usando un mezzo di coltura “xeno-free”, cioè privo di componenti animali (come il siero fetale bovino), per renderlo più standardizzato e potenzialmente più sicuro per future applicazioni cliniche.
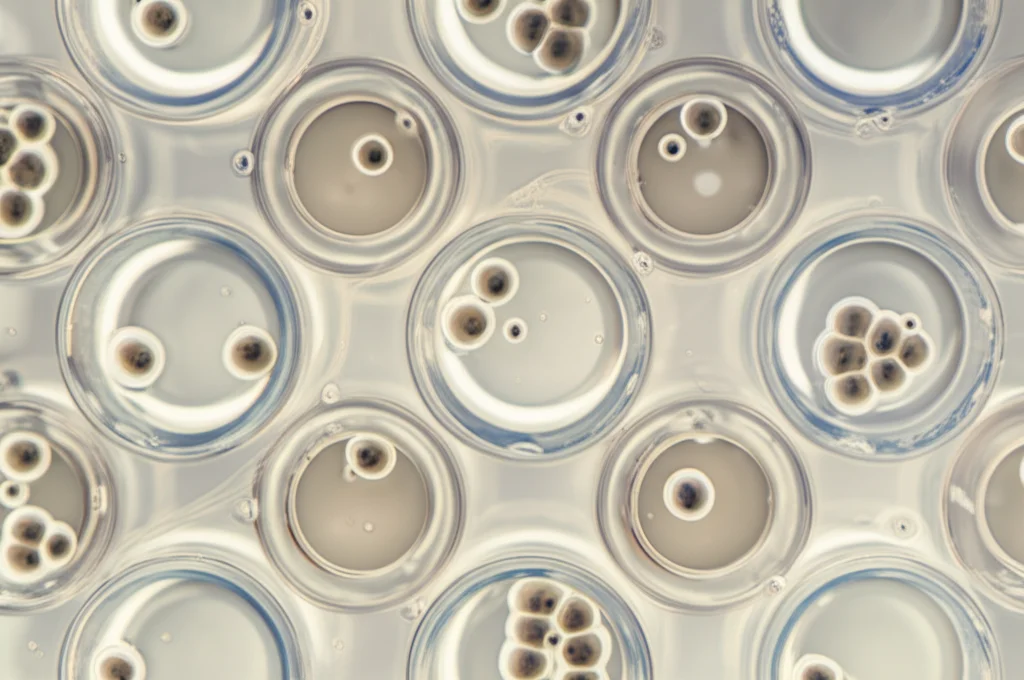
Abbiamo preso campioni di meningioma da pazienti durante l’intervento chirurgico (ovviamente con il loro consenso informato!). Abbiamo isolato le cellule tumorali e le abbiamo coltivate. La vera sfida è stata farle crescere non piatte, ma aggregate in strutture 3D. Per questo, abbiamo usato un idrogel speciale, una sorta di gelatina biocompatibile che fa da impalcatura e permette alle cellule di organizzarsi tridimensionalmente.
Abbiamo provato sia con cellule “fresche” (appena isolate e coltivate per poche generazioni, o passaggi) sia con cellule che erano state congelate e poi scongelate (cosa molto comune nei laboratori per conservare campioni).
Cosa Abbiamo Scoperto: Somiglianze Sorprendenti (e Qualche Differenza)
I risultati sono stati davvero incoraggianti, anche se con qualche sorpresa.
Successo con le cellule fresche, fallimento con quelle congelate: La prima cosa che abbiamo notato è stata una differenza enorme: i modelli 3D si sono formati con successo da *tutti* i campioni di cellule fresche (5 su 5, di cui 4 grado 1 e 1 grado 2), ma *nessuno* dei 12 campioni congelati (che erano al sesto passaggio) è riuscito a formare strutture 3D. Anzi, le cellule sembravano morire. Questo suggerisce che il processo di congelamento/scongelamento e i passaggi cellulari aggiuntivi potrebbero danneggiare la capacità delle cellule di meningioma benigno di formare queste strutture complesse. Un’informazione cruciale per chi lavora con queste cellule!
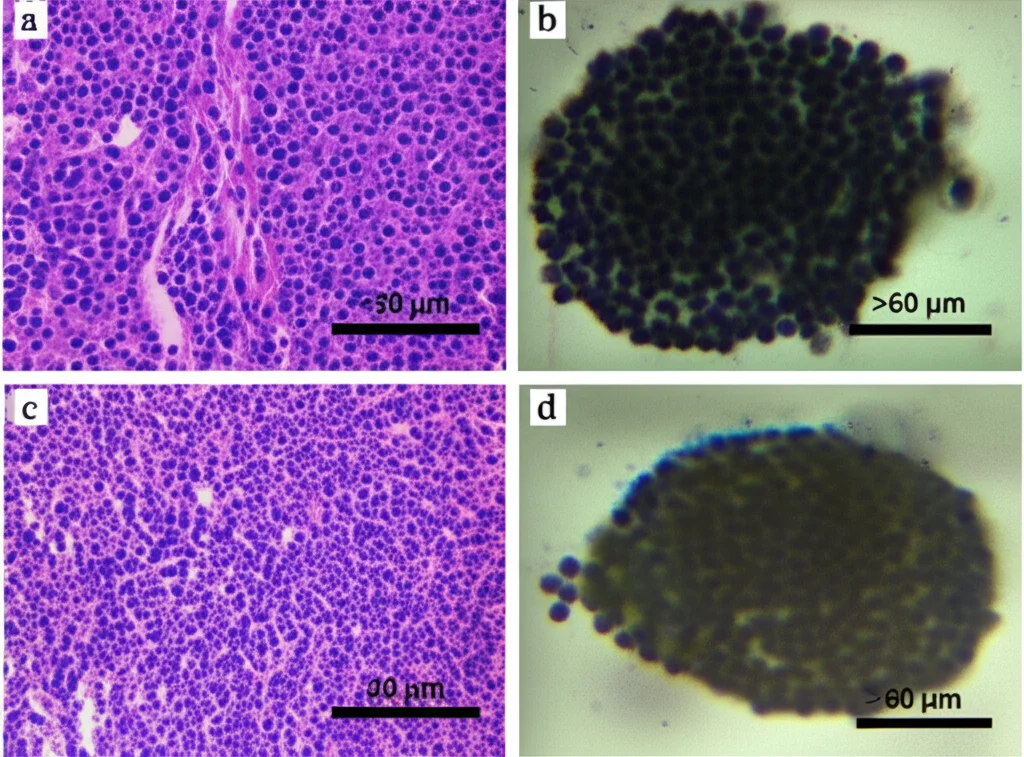
Morfologia: più simili al tumore originale: Abbiamo analizzato i nostri mini-tumori 3D al microscopio (istologia) e li abbiamo confrontati sia con il tumore originale del paziente sia con le colture 2D. Le cellule nei modelli 3D assomigliavano molto di più a quelle del tumore di partenza rispetto alle cellule piatte del 2D. Certo, una cosa che abbiamo perso è stata la componente fibrosa (il tessuto connettivo e il collagene) presente in alcuni meningiomi fibrosi. L’architettura generale non era identica, ma la forma delle singole cellule era ben conservata. Abbiamo anche testato una linea cellulare di meningioma maligno disponibile commercialmente (IOMM-Lee) e abbiamo visto che il modello 3D assomigliava molto al tumore cresciuto in vivo (in un modello animale), più di quanto non facesse il modello 2D.
Marcatori immunohistochimici: un profilo più fedele: Abbiamo poi “colorato” le cellule per vedere quali proteine esprimevano (immunohistochimica), usando marcatori tipici dei meningiomi come EMA, SSTR2, recettore del progesterone (PR) e Ki-67 (che indica la proliferazione). Anche qui, i modelli 3D si sono rivelati più simili ai tumori originali rispetto ai modelli 2D. Ad esempio, l’espressione di EMA e SSTR2, che tendeva a diminuire nel 2D, veniva parzialmente recuperata nel 3D. La scoperta più interessante riguarda il Ki-67: nei modelli 2D, le cellule proliferavano come matte (indice Ki-67 altissimo), molto più che nel tumore originale. Nei nostri modelli 3D, invece, l’indice di proliferazione era molto più basso e simile a quello del tumore primario! Questo è fondamentale, perché molti farmaci antitumorali colpiscono proprio le cellule in rapida divisione. Un modello che replica fedelmente la proliferazione del tumore originale è molto più affidabile per testare farmaci.
Epigenetica: il DNA “vestito” quasi allo stesso modo: Siamo andati ancora più a fondo, analizzando l’epigenetica, in particolare la metilazione del DNA. L’epigenetica è come un insieme di “interruttori” che accendono o spengono i geni senza cambiare la sequenza del DNA. È un aspetto cruciale nella biologia del cancro. Abbiamo confrontato il profilo di metilazione del DNA dei tumori originali con quello dei loro modelli 3D corrispondenti. I risultati? Una correlazione altissima (R > 0.95)! Questo significa che, a livello epigenetico, i nostri modelli 3D sono straordinariamente simili ai tumori da cui derivano. Abbiamo anche guardato le alterazioni nel numero di copie dei cromosomi (Copy Number Variation, CNV) e anche lì i profili erano quasi identici tra tumore e modello 3D.
Certo, abbiamo trovato alcune piccole differenze. Analizzando i singoli “interruttori” (siti CpG), abbiamo visto che nei modelli 3D c’erano leggermente più siti “spenti” (ipometilati) rispetto al tumore originale, soprattutto in geni legati al citoscheletro, alla motilità cellulare e alle interazioni tra cellule e matrice. Questo potrebbe indicare un adattamento delle cellule all’ambiente artificiale della coltura, che è privo delle complesse interazioni presenti nel microambiente tumorale in vivo. Tuttavia, nel complesso, la somiglianza epigenetica è notevole.

Perché Questo Modello è Promettente?
Quindi, cosa significa tutto questo? Significa che siamo riusciti a creare un modello 3D di meningioma derivato dal paziente, in un idrogel xeno-free, che replica fedelmente molte caratteristiche chiave del tumore originale:
- Morfologia cellulare
- Espressione di marcatori importanti
- Tasso di proliferazione (molto meglio del 2D!)
- Profilo epigenetico (metilazione del DNA e CNV)
Questo modello offre un’alternativa più economica e accessibile rispetto ai modelli animali, pur essendo molto più accurato dei modelli 2D tradizionali.
Immaginate le possibilità: potremmo usare questi “avatar” tumorali per testare una batteria di farmaci (sia nuovi che già approvati per altri usi) e vedere quali funzionano meglio per il tumore specifico di quel paziente. Questo aprirebbe la strada a strategie terapeutiche veramente personalizzate per i pazienti con meningioma che non possono essere curati solo con la chirurgia, come quelli con resezioni incomplete, tumori atipici o maligni, o quelli per cui l’intervento è troppo rischioso.
Limiti e Prossimi Passi
Ovviamente, nessun modello è perfetto e anche il nostro ha dei limiti. La necessità di usare cellule fresche e il tempo di incubazione di tre mesi per i tumori benigni potrebbero essere degli ostacoli, anche se per i tumori maligni abbiamo visto che bastano poche settimane. L’estrazione dall’idrogel si è rivelata un po’ complicata per i campioni benigni, causando frammentazione. Inoltre, manca ancora il complesso microambiente tumorale (vasi sanguigni, cellule immunitarie, ecc.), anche se futuri studi potrebbero esplorare la co-coltura con altre cellule.
Nonostante queste sfide, crediamo che questo modello 3D rappresenti un passo avanti significativo. Il prossimo passo sarà validarlo ulteriormente, testare la sua capacità predittiva per l’efficacia dei farmaci e capire come integrarlo al meglio nel percorso clinico per aiutare davvero i pazienti.
La strada verso la medicina personalizzata per i meningiomi è ancora lunga, ma speriamo che il nostro lavoro contribuisca a renderla un po’ più breve e concreta. È affascinante pensare che da un piccolo frammento di tumore si possa costruire in laboratorio uno strumento così potente per guidare le cure future!
Fonte: Springer