MicroRNA Fuori Controllo: Messaggeri Inaspettati che Rimodellano il Nostro Cervello nelle Malattie Neurodegenerative?
Ciao a tutti! Oggi voglio parlarvi di qualcosa che mi affascina incredibilmente e che sta cambiando il modo in cui guardiamo alle malattie neurodegenerative come l’Alzheimer. Immaginate delle minuscole molecole nel nostro corpo, i microRNA (o miRNA), che di solito pensiamo lavorino *dentro* le cellule per regolare quali geni vengono “accesi” o “spenti”. Bene, preparatevi a una sorpresa: sembra che alcuni di questi miRNA possano avventurarsi *fuori* dalle cellule e agire come veri e propri messaggeri, influenzando direttamente la salute e la struttura dei nostri neuroni. È un po’ come scoprire che le lettere che scrivevi solo per te stesso possono uscire dalla busta e iniziare a dare istruzioni al mondo esterno!
Ma cosa sono esattamente i microRNA?
Prima di tuffarci nel vivo della scoperta, facciamo un passo indietro. I microRNA sono piccoli frammenti di RNA non codificante (cioè non traducono direttamente per proteine) che svolgono un ruolo cruciale nella regolazione fine dell’espressione genica. Funzionano un po’ come dei “silenziatori” molecolari: si legano a specifici RNA messaggeri (mRNA) e ne impediscono la traduzione in proteine, o ne promuovono la degradazione. Questo meccanismo è fondamentale per un’infinità di processi biologici, dallo sviluppo alla risposta immunitaria.
Una cosa interessante dei miRNA è che, a differenza di altri tipi di RNA, sono sorprendentemente stabili anche al di fuori delle cellule. Li troviamo infatti circolanti nei nostri fluidi corporei, come il sangue o il liquido cerebrospinale (il fluido che bagna cervello e midollo spinale). Proprio per questa loro stabilità, da tempo si pensa possano essere utili come biomarcatori, cioè come segnali precoci di diverse malattie, incluse quelle neurodegenerative. Ma l’idea che potessero avere un ruolo *attivo* all’esterno delle cellule, come molecole di segnalazione, è relativamente nuova e apre scenari pazzeschi.
La scoperta: miRNA come “ligandi” per i recettori neuronali
Il punto di partenza della nostra ricerca è stato proprio questo: e se alcuni miRNA, la cui espressione è alterata in malattie come l’Alzheimer (AD), potessero agire come segnali diretti per i neuroni? Ci siamo concentrati su una famiglia di recettori presenti sulla membrana delle cellule, i Toll-like receptors (TLR), in particolare TLR7 e TLR8. Questi recettori sono noti per riconoscere RNA a singolo filamento, come quello virale, ma anche quello endogeno, compresi i miRNA. Sono espressi non solo dalle cellule immunitarie del cervello (la microglia), ma anche dai neuroni stessi.
Utilizzando un approccio che combina l’intelligenza artificiale (un algoritmo chiamato BrainDead, addestrato per riconoscere potenziali attivatori di TLR7/8) e l’analisi di database di miRNA associati all’Alzheimer, abbiamo puntato i riflettori su alcuni candidati promettenti. Tra questi, quattro miRNA hanno attirato la nostra attenzione:
- miR-124-5p
- miR-92a-1-5p
- miR-9-5p
- miR-501-3p
Questi miRNA non solo mostrano livelli alterati nell’Alzheimer (alcuni aumentati, altri diminuiti), ma le nostre analisi predittive suggerivano potessero legarsi e attivare TLR7 e/o TLR8.
Per verificare questa ipotesi, abbiamo usato cellule ingegnerizzate che esprimono specificamente TLR7 o TLR8 (sia umani che murini) e che producono un segnale luminoso quando il recettore viene attivato. Ebbene sì! Abbiamo confermato che questi quattro miRNA associati all’AD sono effettivamente in grado di attivare TLR7 e/o TLR8, agendo come veri e propri ligandi endogeni. È importante notare che l’attivazione dipendeva sia dalla sequenza specifica del miRNA sia dalla specie (umana o murina) del recettore, suggerendo una certa specificità in questo dialogo molecolare. Ad esempio, miR-124-5p attivava sia il TLR7 umano che quello murino, mentre miR-92a-1-5p attivava solo quello murino. miR-9-5p e miR-501-3p, invece, mostravano una preferenza per i recettori umani.

Come i miRNA “bussano alla porta” dei neuroni
Ok, abbiamo scoperto che questi miRNA possono “parlare” ai recettori TLR. Ma come fanno a raggiungere questi recettori, che si trovano all’interno di compartimenti cellulari chiamati endosomi? Abbiamo utilizzato tecniche di imaging avanzate (microscopia confocale e live cell imaging) per seguire il percorso di miRNA fluorescenti (miR-124-5p e miR-92a-1-5p) aggiunti all’esterno di neuroni corticali murini in coltura.
Quello che abbiamo visto è stato affascinante: i neuroni “catturavano” attivamente questi miRNA extracellulari attraverso un processo chiamato endocitosi (in particolare, un tipo che dipende da una proteina chiamata dinamina). In pratica, la membrana cellulare si invagina per inglobare il miRNA, formando una piccola vescicola che poi viaggia all’interno della cellula. Abbiamo osservato che già dopo 20 minuti, i miRNA fluorescenti si trovavano all’interno degli endosomi, proprio dove risiedono i recettori TLR7/8. Questo conferma che i miRNA extracellulari non solo possono raggiungere i neuroni, ma possono anche entrare nel compartimento giusto per interagire con i loro recettori bersaglio. È come se avessero la chiave giusta per entrare e raggiungere la stanza di controllo!
L’impatto sui neuroni: struttura, sinapsi e sopravvivenza
Una volta stabilito che questi miRNA possono entrare e attivare i TLR neuronali, la domanda successiva è stata: che effetto hanno sui neuroni? Le malattie neurodegenerative sono caratterizzate dalla perdita progressiva di neuroni e delle loro connessioni (sinapsi), oltre che da alterazioni nella loro struttura (dendriti e assoni). Potevano questi miRNA extracellulari contribuire a questi danni?
Abbiamo esposto neuroni corticali, sia murini che umani (derivati da cellule staminali pluripotenti indotte, i cosiddetti iNeurons), a questi miRNA associati all’AD. I risultati sono stati sorprendenti e complessi:
- Alterazioni strutturali: Abbiamo osservato cambiamenti significativi nella lunghezza e nell’integrità dei dendriti (le “antenne” che ricevono segnali) e degli assoni (i “cavi” che trasmettono segnali). È interessante notare che l’effetto dipendeva dalla specifica sequenza del miRNA: ad esempio, in vitro, miR-92a-1-5p riduceva la lunghezza sia dei dendriti che degli assoni nei neuroni murini, mentre miR-124-5p aumentava la lunghezza degli assoni senza effetti evidenti sui dendriti. Nei neuroni umani, miR-9-5p riduceva la lunghezza assonale, mentre miR-501-3p aumentava quella dendritica. Questo suggerisce che diversi miRNA potrebbero orchestrare risposte strutturali molto specifiche.
- Effetti sulle sinapsi: Abbiamo anche analizzato l’espressione di proteine sinaptiche, cruciali per la comunicazione tra neuroni. Nei neuroni umani, sia miR-9-5p che miR-501-3p aumentavano l’espressione di sinapsina (un marcatore generale delle sinapsi).
- Vitalità neuronale: Purtroppo, l’esposizione a questi miRNA ha avuto anche effetti negativi sulla sopravvivenza dei neuroni. Sia miR-124-5p che miR-92a-1-5p inducevano apoptosi (morte cellulare programmata) nei neuroni murini, un effetto mediato dall’attivazione della caspasi-3 (un enzima chiave nell’apoptosi). Anche nei neuroni umani, miR-9-5p e miR-501-3p riducevano la vitalità neuronale e aumentavano i segnali di apoptosi.
Crucialmente, la maggior parte di questi effetti (sia strutturali che sulla vitalità) dipendeva dall’attivazione dei recettori TLR7 e/o TLR8. Utilizzando neuroni privi di TLR7 (Tlr7-/-) o inibitori specifici per TLR7/8, abbiamo potuto dimostrare che bloccando questa via di segnalazione si prevenivano o si riducevano notevolmente gli effetti indotti dai miRNA.
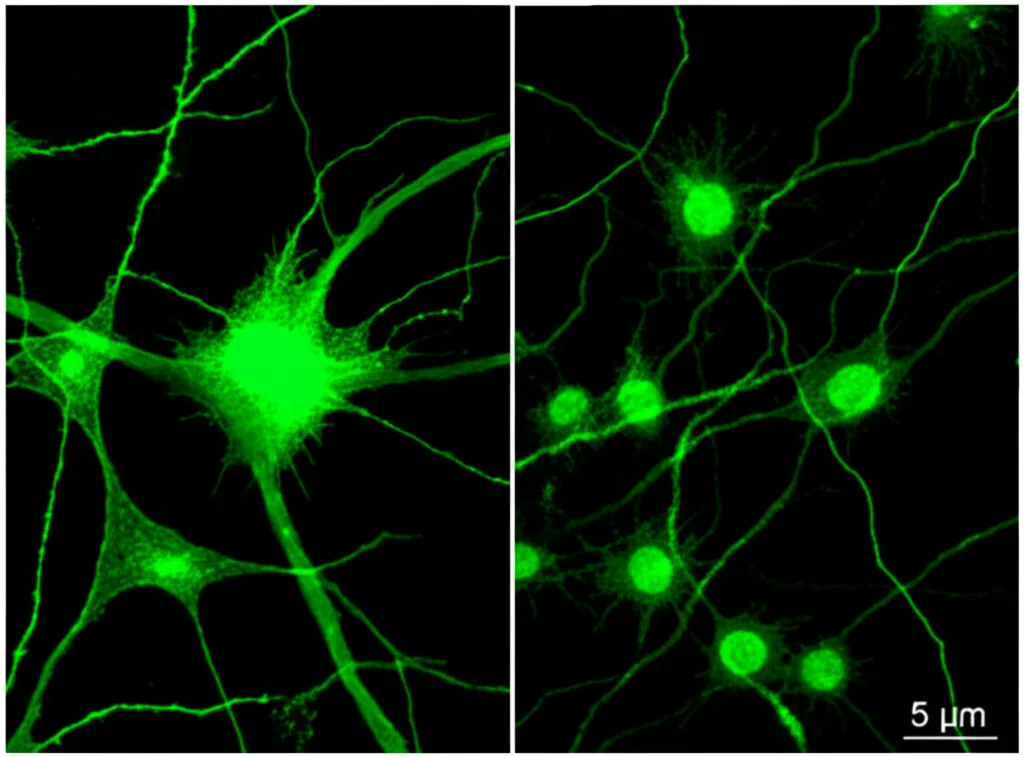
Conferme nel mondo reale: esperimenti in vivo
Le colture cellulari sono utilissime, ma per capire cosa succede davvero nel cervello, dobbiamo passare a modelli più complessi. Abbiamo quindi iniettato direttamente nel liquido cerebrospinale di topi (sia normali che privi di TLR7) i miRNA miR-124-5p e miR-92a-1-5p. Dopo tre giorni, abbiamo analizzato la corteccia cerebrale.
I risultati *in vivo* hanno confermato e ampliato quanto visto in vitro. Abbiamo osservato:
- Alterazioni nella struttura di dendriti e assoni, anche qui con effetti specifici per ciascun miRNA.
- Cambiamenti nell’abbondanza di proteine sinaptiche (ad esempio, una riduzione di sinaptofisina dopo trattamento con miR-92a-1-5p).
- Una significativa perdita neuronale nella corteccia dei topi trattati con miR-124-5p o miR-92a-1-5p.
Ancora una volta, la maggior parte di questi effetti dannosi era dipendente da TLR7: nei topi privi di questo recettore, la perdita neuronale indotta dai miRNA era completamente prevenuta. Questo rafforza l’idea che l’interazione miRNA-TLR7 sia un meccanismo chiave di danno neuronale nel contesto delle malattie neurodegenerative.
Cambiano le regole del gioco: effetti sull’espressione genica
Per capire più a fondo come questi miRNA extracellulari influenzano i neuroni, abbiamo analizzato l’intero trascrittoma (l’insieme di tutti gli RNA messaggeri) di neuroni murini esposti a miR-124-5p e miR-92a-1-5p. Abbiamo osservato cambiamenti nell’espressione di centinaia di geni, sia a breve termine (6 ore) che a lungo termine (5 giorni).
Le analisi bioinformatiche hanno rivelato che i geni modificati erano coinvolti in percorsi cruciali come:
- Infiammazione (es. vie di segnalazione di TNF e IL-6)
- Proliferazione cellulare (es. controllo del ciclo cellulare)
- Apoptosi
Questo conferma che i miRNA, agendo come segnali esterni sui TLR, possono innescare profonde modifiche nel programma genetico dei neuroni.
Ma ecco un punto davvero fondamentale: abbiamo verificato se i geni modificati fossero i bersagli “canonici” di questi miRNA (cioè quelli che normalmente silenziano *dall’interno* della cellula). Sorprendentemente, non abbiamo trovato una correlazione significativa. Questo suggerisce fortemente che l’effetto principale di questi miRNA *extracellulari* non sia dovuto al loro classico meccanismo di silenziamento genico, ma piuttosto alla loro capacità di agire come ligandi per i TLR, attivando cascate di segnali intracellulari completamente diverse. È una distinzione cruciale: lo stesso miRNA può avere funzioni radicalmente differenti a seconda che si trovi dentro o fuori dalla cellula!

Complessità e prospettive future
Questa ricerca apre un nuovo capitolo nella comprensione delle malattie neurodegenerative. Dimostra che i miRNA associati a queste patologie non sono solo potenziali biomarcatori passivi, ma possono essere attori attivi nel processo di neurodegenerazione, agendo come molecole di segnalazione extracellulare che modulano la struttura e la sopravvivenza dei neuroni attraverso i recettori TLR7/8.
Certo, il quadro è complesso. Abbiamo visto che gli effetti dipendono dalla specifica sequenza del miRNA, dal tipo di recettore TLR coinvolto (e dalla sua specie), e probabilmente da un intricato dialogo tra TLR7 e TLR8, specialmente nei neuroni umani. Inoltre, alcuni effetti sembrano addirittura opposti (es. aumento della lunghezza assonale ma anche induzione di morte cellulare per miR-124-5p), suggerendo che un singolo miRNA possa attivare vie multiple con esiti diversi, alcune dipendenti da TLR e altre forse no.

Quello che mi entusiasma è che questa scoperta non solo ci aiuta a capire meglio i meccanismi alla base dell’Alzheimer e di altre malattie simili, ma potrebbe anche aprire la strada a nuove strategie terapeutiche. Se riusciamo a decifrare questo complesso linguaggio dei miRNA extracellulari e a capire come bloccare le loro interazioni dannose con i TLR neuronali, potremmo avere nuove armi per combattere la neurodegenerazione.
Il viaggio nella comprensione del cervello è pieno di sorprese, e scoprire che queste minuscole molecole di RNA possono agire come potenti messaggeri extracellulari è una di quelle che ci ricorda quanto ancora abbiamo da imparare. Continueremo a indagare, spinti dalla curiosità e dalla speranza di trovare soluzioni per queste malattie devastanti.
Fonte: Springer







