Microbiota Intestinale e Dolore Neuropatico Diabetico: Cosa Ci Dicono i Topi?
Amici scienziati (e non!), oggi vi porto in un viaggio affascinante nel nostro corpo, o meglio, in quello dei nostri amici roditori, per capire un problema che affligge tantissime persone: la neuropatia diabetica dolorosa (PDN). Sapete, quel dolore bruciante, quelle scosse elettriche alle mani e ai piedi che possono rendere la vita un vero incubo per chi soffre di diabete. E se vi dicessi che una parte della risposta potrebbe nascondersi nel nostro intestino, più precisamente nel microbiota intestinale? Sembra strano, vero? Eppure, la scienza ci sta aprendo porte incredibili!
Recentemente, mi sono imbattuto in uno studio super interessante (pubblicato su Springer, vi lascio il link alla fine!) che ha messo sotto la lente d’ingrandimento proprio questa connessione in un modello animale, i ratti. L’obiettivo? Capire se e come cambia il microbiota intestinale nei ratti con PDN rispetto a quelli sani, e cosa questo significhi.
Creare un “Topo Diabetico Dolorante”: La Sfida del Modello Sperimentale
Per prima cosa, i ricercatori hanno dovuto “creare” dei ratti con diabete di tipo 2 e neuropatia dolorosa. Come? Con una dieta bella ricca di grassi e zuccheri (un po’ come le nostre tentazioni quotidiane, ahimè!) combinata con una piccola dose di streptozotocina, una sostanza che danneggia le cellule produttrici di insulina. Hanno poi monitorato attentamente questi ratti, controllando il loro metabolismo del glucosio, la sensibilità all’insulina e, ovviamente, la progressione della neuropatia. Per quest’ultima, hanno usato test comportamentali che misurano la soglia del dolore a stimoli meccanici e termici. Immaginatevi dei piccoli test per vedere quanto velocemente il ratto ritira la zampetta se toccata o esposta a calore: una soglia più bassa significa più dolore, più sensibilità.
I risultati non si sono fatti attendere: i ratti “diabetici” (chiamiamoli gruppo PDN) hanno mostrato i classici sintomi: glicemia alle stelle, perdita di peso (nonostante mangiassero e bevessero di più, tipico del diabete scompensato), e una ridotta capacità di gestire il glucosio, segno di insulino-resistenza. E, cosa cruciale per lo studio, avevano una soglia del dolore decisamente più bassa. Insomma, il modello funzionava: avevamo dei ratti con neuropatia diabetica dolorosa.
L’Intestino Sotto Stress: Barriera Compromessa e Infiammazione a Go-Go
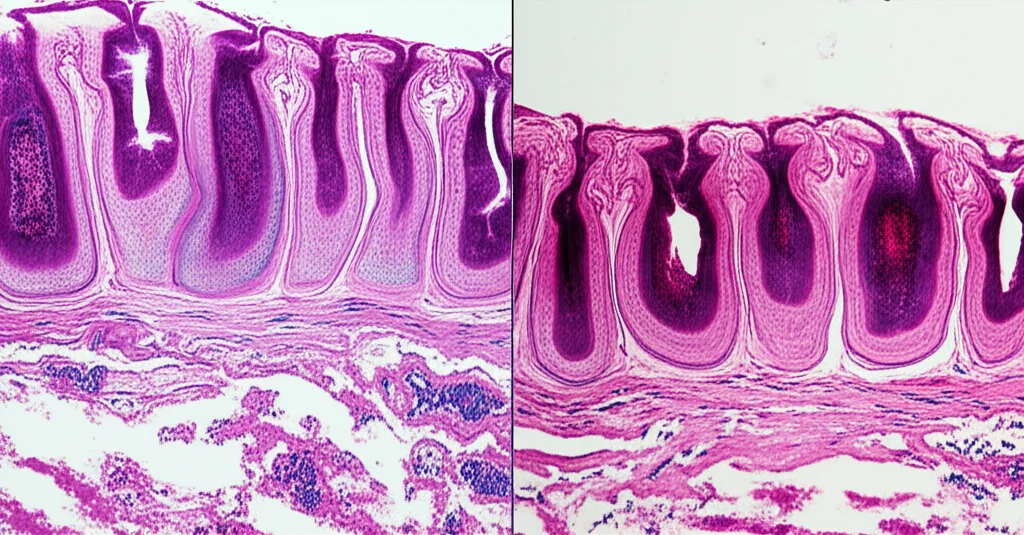
Ma cosa succedeva nel loro intestino? Qui le cose si fanno ancora più interessanti. L’analisi dei tessuti del colon dei ratti PDN ha rivelato un quadro non proprio allegro: danni significativi alla mucosa, perdita di integrità e un sacco di cellule infiammatorie infiltrate. Questo suggerisce che la barriera intestinale, quella specie di muro di cinta che dovrebbe proteggerci, era compromessa. Un po’ come avere un “intestino bucherellato” (il famoso “leaky gut”).
E l’infiammazione non si fermava lì. I ricercatori hanno misurato i livelli di citochine pro-infiammatorie (TNF-α e IL-1β, dei veri e propri messaggeri dell’infiammazione) nel tessuto del midollo spinale. Risultato? Livelli significativamente più alti nei ratti PDN. Questo è un indizio pesante: l’infiammazione periferica, forse partita proprio dall’intestino, sembra giocare un ruolo chiave nel sensibilizzare il sistema nervoso e quindi nel generare dolore.

Pensateci: un intestino che “perde” permette a sostanze non gradite, come tossine batteriche (il famoso lipopolisaccaride o LPS), di passare nel sangue, scatenando un’infiammazione sistemica che può arrivare fino al midollo spinale, amplificando la percezione del dolore. È come se l’intestino, da nostro alleato, diventasse una fonte di problemi.
Il Microbiota Scombussolato: Chi C’è e Chi Manca all’Appello
A questo punto, la domanda sorge spontanea: e i batteri intestinali? Cosa combinavano? Per scoprirlo, sono stati raccolti campioni fecali e analizzati con sequenziamento metagenomico, una tecnica potentissima che ci dice chi c’è (la composizione del microbiota) e cosa fa (le sue funzioni metaboliche).
Le analisi hanno rivelato differenze significative nella composizione del microbiota tra i ratti PDN e quelli sani. Anche se la diversità generale (quanti tipi diversi di batteri ci sono) non era poi così diversa, la struttura della comunità microbica lo era eccome. Un po’ come avere due foreste con lo stesso numero di specie di alberi, ma con proporzioni completamente diverse tra querce, pini e faggi.
In particolare, nei ratti PDN è stato osservato un aumento del rapporto tra Bacillota (precedentemente noti come Firmicutes) e Bacteroidota (precedentemente Bacteroidetes). Questo rapporto è spesso alterato in condizioni di obesità e diabete di tipo 2, suggerendo uno squilibrio metabolico. Ma la vera sorpresa è stata l’aumento dell’abbondanza di Lactobacillus. Aspetta un attimo, direte voi, i Lattobacilli non sono quelli “buoni”? Generalmente sì, sono probiotici noti per i loro effetti benefici. Tuttavia, in questo contesto, un loro aumento potrebbe essere una risposta adattativa del corpo allo stato diabetico e infiammatorio, o forse un segnale che non tutti i Lattobacilli si comportano allo stesso modo in tutte le condizioni. La scienza è complessa, amici!
Al contrario, è diminuita l’abbondanza di Prevotella, un genere batterico che in altri contesti è stato associato a diete ricche di fibre e a un metabolismo più sano. L’analisi LEfSe, che va a caccia dei “biomarcatori” microbici, ha confermato l’arricchimento di specie come Lactobacillus-acidophilus e Lactobacillus-paragasseri nei ratti PDN, mentre altri batteri, come quelli del genere Ligilactobacillus, erano più abbondanti nei ratti sani.
Non Solo Chi C’è, Ma Cosa Fa: Le Funzioni Metaboliche Alterate
Ma non basta sapere chi c’è, bisogna capire cosa fanno questi batteri. L’analisi funzionale, basata su database come KEGG, EggNOG e CAZy, ha mostrato che nei ratti PDN c’era un arricchimento significativo di vie metaboliche legate al metabolismo dei carboidrati e degli amminoacidi, al metabolismo energetico e alla biogenesi della struttura cellulare. In pratica, il microbiota dei ratti PDN sembrava essere “iperattivo” nel processare zuccheri e proteine, forse come tentativo di adattarsi all’ambiente iperglicemico dell’ospite.
Ad esempio, vie come il metabolismo della D-Alanina, la biosintesi degli amminoacil-tRNA (essenziali per costruire proteine), e la glicolisi/gluconeogenesi (per produrre energia dagli zuccheri) erano potenziate. Anche le funzioni legate al trasporto e metabolismo dei carboidrati e degli amminoacidi, e alla costruzione della parete cellulare batterica erano più attive. Questo suggerisce che il microbiota sta cercando di far fronte a un surplus di nutrienti o a uno stress metabolico, ma questa iperattività potrebbe anche contribuire all’infiammazione e al peggioramento della PDN.
L’Asse Intestino-Midollo Spinale: Un Dialogo Pericoloso
Mettiamo insieme i pezzi. Abbiamo un microbiota alterato, una barriera intestinale che fa acqua e un’infiammazione che arriva fino al midollo spinale. Come si collegano? L’ipotesi è che la disbiosi intestinale (cioè l’alterazione del microbiota) porti a un aumento della permeabilità intestinale. Questo permette a mediatori infiammatori e tossine batteriche di entrare in circolo e raggiungere il sistema nervoso centrale, incluso il midollo spinale. Qui, possono scatenare o peggiorare l’infiammazione locale, sensibilizzando i neuroni del dolore.
Lo studio menziona anche il sistema glinfatico del midollo spinale, una sorta di sistema di pulizia che rimuove i rifiuti metabolici. Ricerche precedenti degli stessi autori avevano suggerito che nella PDN questo sistema di pulizia funziona meno bene, e l’accumulo di “spazzatura” infiammatoria potrebbe peggiorare il dolore. Un circolo vizioso: l’infiammazione si accumula, il sistema di pulizia è inefficiente, l’infiammazione si amplifica.
E non dimentichiamo gli acidi grassi a catena corta (SCFA), come acetato, propionato e butirrato. Prodotti dalla fermentazione delle fibre da parte dei batteri “buoni”, gli SCFA hanno generalmente effetti anti-infiammatori e protettivi. Una disbiosi potrebbe significare meno SCFA, e quindi meno protezione.
Cosa Ci Portiamo a Casa? Prospettive Future (e Limiti)
Questo studio, seppur condotto su ratti, ci dà una nuova, importante tessera del puzzle. Dimostra che la neuropatia diabetica dolorosa non è solo una questione di nervi danneggiati dallo zucchero, ma coinvolge un attore complesso e dinamico come il microbiota intestinale. Le alterazioni nella sua composizione e funzione, la compromissione della barriera intestinale e l’infiammazione sistemica sembrano contribuire in modo significativo alla patologia.
Certo, ci sono dei limiti. Il campione di ratti analizzati alla fine era piccolo, e il modello animale, per quanto utile, non replica mai perfettamente la complessità della malattia umana. Anche le differenze di dieta nelle fasi iniziali potrebbero aver influenzato i risultati. Tuttavia, i risultati sono promettenti.
La grande speranza è che, capendo meglio questi meccanismi, si possano sviluppare nuove strategie terapeutiche. Immaginate di poter alleviare il dolore della PDN modulando il microbiota intestinale con probiotici specifici, prebiotici, o magari trapianti di microbiota fecale. Oltre, ovviamente, a interventi dietetici mirati. Aumentare le fibre, ridurre i grassi saturi e gli zuccheri semplici potrebbe già fare una grande differenza, non solo per il diabete in sé, ma anche per le sue complicanze dolorose, agendo proprio sull’equilibrio del nostro “secondo cervello”, l’intestino.
Insomma, la strada è ancora lunga, ma studi come questo ci ricordano quanto sia interconnesso il nostro organismo e come, a volte, la soluzione a problemi complessi possa trovarsi in luoghi inaspettati. Teniamo d’occhio il nostro intestino, amici, potrebbe riservarci ancora molte sorprese!
Fonte: Springer







