Microbi Costruttori: Salinità, pH e i Segreti delle Microbialiti Peritidali
Ciao a tutti! Oggi voglio portarvi in un viaggio affascinante nel mondo microscopico che costruisce letteralmente le rocce sotto i nostri piedi, o meglio, sotto le onde delle zone costiere. Parleremo di microbialiti, strutture incredibili create da comunità di microbi, e di come fattori ambientali apparentemente semplici come la salinità e il pH possano orchestrare la loro formazione. Immaginate queste strutture come dei veri e propri archivi geologici viventi, capaci di raccontarci storie antichissime del nostro pianeta.
Microbialiti: Archivi Viventi della Terra
Le microbialiti sono tra le più antiche testimonianze di vita sulla Terra, con fossili che risalgono a oltre 3,4 miliardi di anni fa! Sono essenzialmente depositi rocciosi (spesso carbonatici) formati grazie all’attività di microrganismi, come batteri, alghe e archaea. Oggi, non le troviamo ovunque come un tempo. Si sono ritirate in ambienti un po’ particolari, spesso estremi, dove la competizione con organismi più complessi è minore o dove le condizioni chimiche ne favoriscono la crescita continua. Pensate a laghi ipersalini, sorgenti termali, grotte, ma anche, e qui entra in gioco il nostro studio, le zone peritidali. Queste sono le aree costiere soggette all’alternanza delle maree, un ambiente dinamico dove l’acqua dolce proveniente da terra incontra l’acqua salata del mare. Proprio questa mescolanza crea gradienti ambientali unici che influenzano profondamente i microbi che ci vivono.
Non Solo Fotosintesi: I Molteplici Modi in cui i Microbi Costruiscono Rocce
Storicamente, quando si pensava alla formazione delle microbialiti, i riflettori erano puntati quasi esclusivamente sui microbi fotosintetici, in particolare i cianobatteri. È vero, la fotosintesi gioca un ruolo importante: consumando CO₂ e rilasciando ioni OH⁻, aumenta il pH dell’acqua circostante, favorendo la precipitazione dei carbonati (come il carbonato di calcio, CaCO₃). Ma la storia è molto più complessa e affascinante! Ci siamo resi conto che molti altri processi microbici contribuiscono a questo fenomeno, noto come Precipitazione Carbonatica Microbicamente Indotta (MICP). Quali sono?
- Produzione di Sostanze Polimeriche Extracellulari (EPS): una sorta de “colla” biologica che intrappola sedimenti e ioni.
- Solfato-riduzione: un processo anaerobico che aumenta l’alcalinità.
- Ossidazione anaerobica del metano.
- Processi legati al ciclo dell’azoto: come l’ammonificazione (degradazione di amminoacidi), l’ureolisi (degradazione dell’urea) e la denitrificazione.
Ognuno di questi meccanismi, a suo modo, modifica la chimica locale dell’acqua (aumentando pH, alcalinità o concentrazione di carbonati) e spinge verso la formazione di minerali. Nelle zone peritidali, con la loro miscela di acque dolci e marine, è probabile che diversi di questi processi si alternino o coesistano. Questo ci ha spinto a chiederci: stiamo forse sottovalutando il ruolo dei microbi non fotosintetici in questi ambienti?

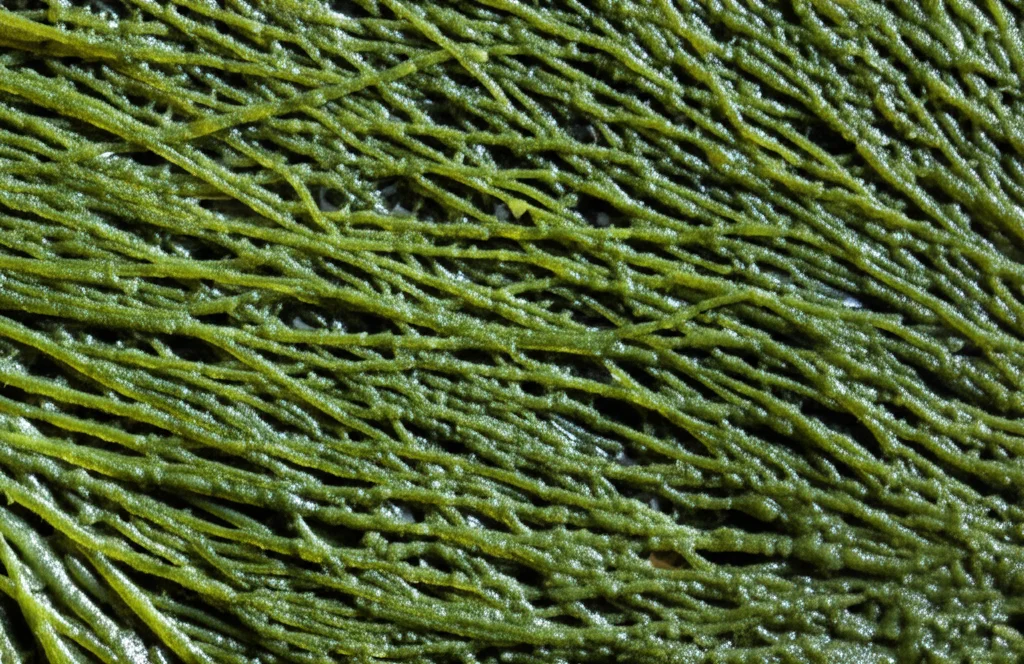
Il Campo di Studio: Le Pozze di Marea di Fongchueisha, Taiwan
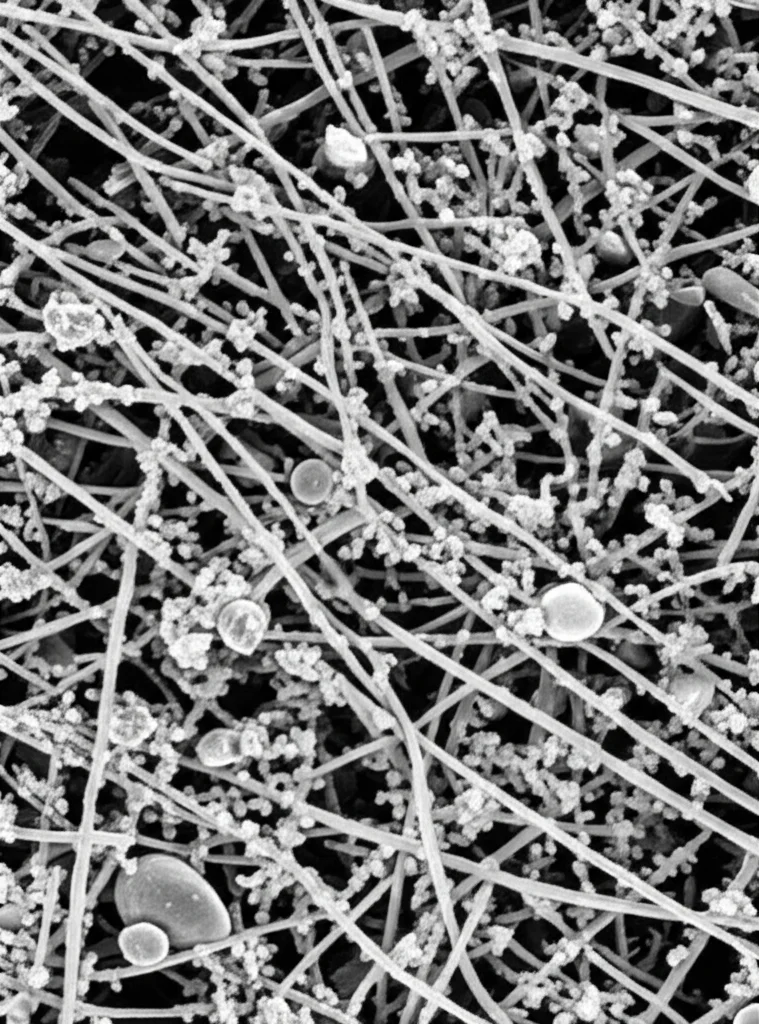
Per investigare queste domande, abbiamo scelto un sito molto interessante a Fongchueisha, nel sud di Taiwan. Qui, lungo la costa, si trovano delle bellissime microbialiti moderne che si formano in una serie di pozze di marea distribuite dalla zona più vicina a terra (influenzata dall’acqua dolce) fino alla zona più bassa dell’intertidale (quasi sempre marina). Abbiamo campionato queste microbialiti in tre pozze rappresentative di questo gradiente (chiamate pool 0, 12 e 30, indicando la distanza progressiva dal punto di riferimento terrestre) e in diversi momenti dell’anno, prelevando campioni sia dalla superficie che dal fondo delle pozze. Oltre ai campioni biologici, abbiamo misurato parametri ambientali chiave come temperatura, salinità, solidi disciolti totali (TDS), ossigeno disciolto (DO) e, ovviamente, il pH. Poi, in laboratorio, abbiamo usato tecniche di sequenziamento di nuova generazione (NGS) per analizzare il DNA dei batteri (gene 16S rRNA) e degli eucarioti (gene 18S rRNA) presenti, per capire chi c’era e come le comunità cambiavano nello spazio e nel tempo. Abbiamo anche usato il microscopio elettronico a scansione (SEM) per osservare la microstruttura delle microbialiti.
Salinità vs pH: Chi Comanda Davvero?
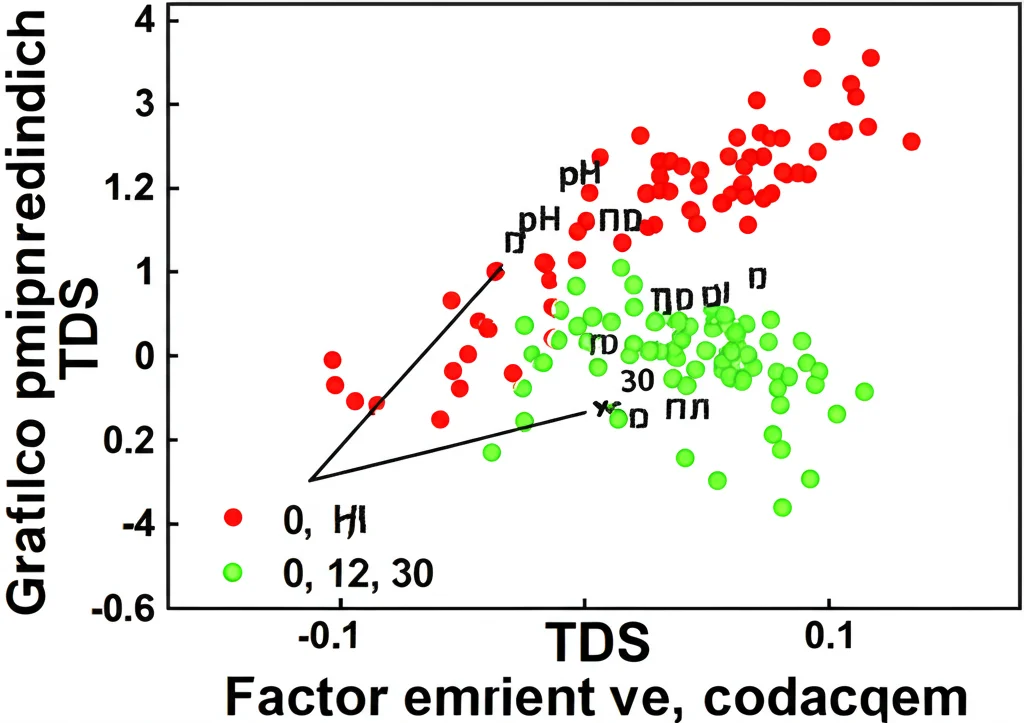
I nostri risultati hanno rivelato un quadro complesso. Come ci aspettavamo, la salinità aveva un impatto sulla composizione delle comunità batteriche dominanti, come i Cianobatteri e gli Alphaproteobacteria. Ad esempio, la pozza 30, la più vicina al mare, mostrava condizioni di salinità, TDS e pH generalmente più elevate, soprattutto sul fondo, rispetto alle pozze 0 e 12. Tuttavia, analizzando le correlazioni, è emerso un dato sorprendente: il pH sembrava avere una correlazione ancora più forte della salinità con la struttura complessiva della comunità microbica. Questo suggerisce che, sebbene la salinità sia un fattore selettivo importante, le variazioni di acidità/basicità dell’acqua potrebbero giocare un ruolo ancora più diretto nel determinare quali microbi prosperano e quali no in queste pozze. Anche la diversità microbica (quante specie diverse ci sono) non era direttamente legata alla salinità, ma alcuni indici di diversità mostravano correlazioni significative con temperatura, ossigeno disciolto e, ancora una volta, pH.
Un Cambio di Strategia: L’Azoto nelle Acque Salate
Un altro aspetto affascinante riguarda il metabolismo dell’azoto. L’azoto è un nutriente essenziale per la vita. Alcuni microbi, come certi cianobatteri dotati di cellule speciali chiamate eterocisti (ad esempio, quelli della famiglia Nostocaceae), sono capaci di “fissare” l’azoto atmosferico (N₂), trasformandolo in ammoniaca utilizzabile. Questo processo, chiamato diazotrofia, richiede molta energia. Abbiamo osservato che i cianobatteri eterocistati erano più abbondanti nella pozza 0, quella con acqua più dolce e pH tendenzialmente più basso. Man mano che ci si spostava verso la pozza 30, con salinità e pH più alti, questi diminuivano, lasciando spazio a cianobatteri filamentosi o unicellulari non eterocistati (come Oxyphotobacteria incertae sedis e Xenococcaceae). Questa tendenza era già stata ipotizzata: vivere in acqua salata costa energia (per mantenere l’equilibrio osmotico), e forse questa energia extra rende la fissazione dell’azoto troppo “costosa”. Cosa fanno allora i microbi nella pozza 30 per procurarsi l’azoto? Sembra che cambino strategia! Invece di fissare l’N₂, potrebbero preferire utilizzare forme di azoto già disponibili nell’ambiente, come l’urea o gli amminoacidi. E qui le cose si fanno interessanti per la formazione delle rocce…
Ureolisi e Ammonificazione: Motori Nascosti della Precipitazione
Se i microbi iniziano a utilizzare urea e amminoacidi come fonte di azoto, attivano processi metabolici come l’ureolisi e l’ammonificazione. L’ureolisi, catalizzata dall’enzima ureasi, scinde l’urea in ammoniaca (NH₃) e CO₂. L’ammonificazione degrada gli amminoacidi producendo anch’essa ammoniaca. L’ammoniaca, in acqua, si trasforma in ione ammonio (NH₄⁺) e ione idrossido (OH⁻). Ed ecco il punto chiave: il rilascio di OH⁻ fa aumentare il pH locale! Inoltre, la CO₂ prodotta può contribuire ad aumentare la concentrazione di carbonato disciolto. Entrambi questi effetti – aumento del pH e del carbonato – spingono fortemente verso la precipitazione del carbonato di calcio (CaCO₃). Quindi, questo cambio di strategia nell’utilizzo dell’azoto, favorito dalle condizioni di alta salinità e pH, potrebbe essere un meccanismo cruciale di MICP, soprattutto negli ambienti più marini. Abbiamo trovato indizi a sostegno di questa ipotesi:
- Nella pozza 30, abbiamo osservato un aumento di batteri potenzialmente coinvolti in questi processi. Ad esempio, batteri del genere Myxococcus (famiglia Myxococcaceae), noti per utilizzare amminoacidi e capaci di favorire la nucleazione dei carbonati, erano più abbondanti sul fondo delle pozze 12 e 30. Le immagini SEM hanno anche rivelato cellule a forma di bastoncello compatibili con questi batteri.
- Un altro gruppo interessante è la famiglia Cellulomonadaceae (Actinobacteriota), significativamente più abbondante nella pozza 30 e correlata positivamente con salinità e pH. Alcuni membri di questa famiglia sono noti produttori di ureasi, l’enzima chiave dell’ureolisi. Il pH ottimale per l’ureasi è intorno a 8, e i valori di pH nella pozza 30 (spesso tra 8.09 e 8.35) sembrano ideali.
- Anche alcuni Alphaproteobacteria (come Rhodobacteraceae) e Cianobatteri (come Xenococcaceae), più abbondanti nella pozza 30, sono stati associati in altri studi a geni per l’ureolisi.
Uno Sguardo al Microscopio e alle Funzioni
Le osservazioni al microscopio elettronico (SEM) hanno confermato che la struttura fisica delle microbialiti variava tra le pozze e anche tra superficie e fondo all’interno della stessa pozza. La microbialite sul fondo della pozza 30 appariva strutturalmente più semplice, con molte cellule filamentose o a bastoncello, suggerendo una comunità e forse processi di formazione distinti. Per capire meglio cosa stessero facendo questi microbi dal punto di vista metabolico, abbiamo usato uno strumento bioinformatico chiamato PICRUSt2. Questo ci permette di predire le potenziali funzioni metaboliche presenti nella comunità batterica a partire dai dati del gene 16S rRNA. L’analisi ha mostrato un chiaro cambiamento nelle funzioni metaboliche prevalenti passando dalla pozza 0 (vicina a terra) alla pozza 30 (vicina al mare). In particolare, nella pozza 30 erano significativamente arricchiti percorsi metabolici legati alla degradazione di acidi nucleici e amminoacidi, e soprattutto, percorsi legati al ciclo dell’urea. Questo supporta ulteriormente l’idea che l’ureolisi e l’ammonificazione siano processi metabolicamente importanti in quell’ambiente, contribuendo potenzialmente alla MICP.
Il Ruolo delle Diatomee e le Interazioni Complesse
Non dimentichiamoci degli eucarioti! Anche le loro comunità variavano significativamente tra le pozze. Le diatomee (Bacillariophyta) erano il gruppo dominante. È interessante notare che alcune diatomee sono note per avere simbiosi con cianobatteri azotofissatori (come quelli del genere Calothrix, che abbiamo trovato abbondante nella pozza 0). Anche le diatomee possiedono un ciclo dell’urea, anche se non è chiaro se questo possa contribuire direttamente alla MICP nell’ambiente esterno. Tuttavia, la loro presenza e variazione suggeriscono che anche gli eucarioti fanno parte di questa complessa rete di interazioni e potrebbero influenzare, o essere influenzati da, i cicli dei nutrienti come quello dell’azoto. L’analisi delle reti di co-occorrenza batterica ha inoltre mostrato come le interazioni tra i diversi gruppi batterici cambiassero a seconda del cianobatterio dominante (Nostocaceae nella pozza 0 vs Oxyphotobacteria incertae sedis nella pozza 30), sottolineando la complessità dell’ecosistema.
In conclusione, questo studio ci mostra come la formazione delle microbialiti nelle zone peritidali sia un processo incredibilmente dinamico e sfaccettato, fortemente influenzato da gradienti ambientali come la salinità e, in modo forse ancora più determinante, il pH. Non è solo la fotosintesi a guidare la costruzione di queste rocce biologiche. Abbiamo visto come, in condizioni di maggiore salinità e pH, le comunità microbiche sembrino spostare le loro strategie per l’acquisizione dell’azoto, riducendo la costosa fissazione dell’N₂ e favorendo l’utilizzo di urea e amminoacidi. Questi processi alternativi, come l’ureolisi e l’ammonificazione, diventano a loro volta potenti motori per la precipitazione dei carbonati, agendo in sinergia o addirittura prevalendo sulla fotosintesi in certi microambienti. È affascinante pensare a queste comunità microbiche come a delle vere e proprie fabbriche chimiche in miniatura, che rispondono ai cambiamenti ambientali modificando il loro metabolismo e, così facendo, costruiscono strutture geologiche durature. Studiare le microbialiti moderne non è solo un viaggio affascinante nel presente, ma ci fornisce anche preziose chiavi di lettura per interpretare le tracce di vita antichissima conservate nelle rocce del nostro pianeta.
Fonte: Springer







